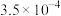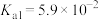1 . 按要求完成下列空白处
(1)已知25℃时弱电解质的电离平衡常数: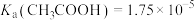 ,
, 。使
。使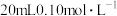 的
的 溶液和
溶液和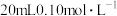 的
的 溶液分别与
溶液分别与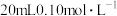 的
的 溶液反应,实验测得产生的
溶液反应,实验测得产生的 气体体积(V)与时间(t)的关系如图所示。
气体体积(V)与时间(t)的关系如图所示。

①反应开始时,两种溶液产生 的速率明显不同的原因是
的速率明显不同的原因是___________ ;
②用蒸馏水稀释0.10 mol/L的醋酸溶液,下列各式表示的数值随水量的增加而增大的是___________ (填序号)。
a. b.
b. c.
c. d.
d. 
(2)现有 的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),实验测得25℃时平衡体系中
的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),实验测得25℃时平衡体系中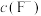 、
、 与溶液pH的关系如图所示(已知
与溶液pH的关系如图所示(已知 时溶液中
时溶液中 的浓度为
的浓度为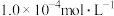 ):25℃时,
):25℃时, 的电离平衡常数
的电离平衡常数
___________ 。

(1)已知25℃时弱电解质的电离平衡常数:
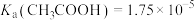 ,
, 。使
。使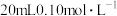 的
的 溶液和
溶液和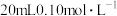 的
的 溶液分别与
溶液分别与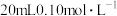 的
的 溶液反应,实验测得产生的
溶液反应,实验测得产生的 气体体积(V)与时间(t)的关系如图所示。
气体体积(V)与时间(t)的关系如图所示。
①反应开始时,两种溶液产生
 的速率明显不同的原因是
的速率明显不同的原因是②用蒸馏水稀释0.10 mol/L的醋酸溶液,下列各式表示的数值随水量的增加而增大的是
a.
 b.
b. c.
c. d.
d. 
(2)现有
 的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),实验测得25℃时平衡体系中
的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),实验测得25℃时平衡体系中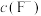 、
、 与溶液pH的关系如图所示(已知
与溶液pH的关系如图所示(已知 时溶液中
时溶液中 的浓度为
的浓度为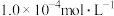 ):25℃时,
):25℃时, 的电离平衡常数
的电离平衡常数

您最近一年使用:0次
2 . 在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,请填写下列空白。

(1)a、b、c三点对应的溶液中,c(H+)由大到小的顺序为___________ (用a、b、c表示,下同),醋酸的电离程度由大到小的顺序为___________ 。
(2)若使c点溶液中c(CH3COO-)增大,可采取的措施是___________(填字母)。
(3)25 ℃时,醋酸的电离平衡常数Ka=1.8×10-5,0.1 mol·L-1醋酸溶液中c(H+)=___________ (已知: =1.34)。
=1.34)。
(4)c(H+)相同、体积相同的盐酸和醋酸溶液分别与足量的锌反应,生成的H2在相同状况下的体积分别为V1和V2,则V1___________ V2(填“>”“<”或“=”,下同);物质的量浓度相同、体积相同的盐酸和醋酸溶液分别与足量的锌反应,生成的H2在相同状况下的体积分别为V3和V4,则V3___________ V4

(1)a、b、c三点对应的溶液中,c(H+)由大到小的顺序为
(2)若使c点溶液中c(CH3COO-)增大,可采取的措施是___________(填字母)。
| A.加水 | B.加入少量固体CH3COONa | C.加少量浓盐酸 | D.加入少量浓氨水 |
 =1.34)。
=1.34)。(4)c(H+)相同、体积相同的盐酸和醋酸溶液分别与足量的锌反应,生成的H2在相同状况下的体积分别为V1和V2,则V1
您最近一年使用:0次
名校
3 . 醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中 增大___________。
增大___________。
(2)向100mL0.1mol·L-1的醋酸中加入VmL0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”,“<”或“=”)。
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中: =18,则此时溶液的pH=
=18,则此时溶液的pH=___________ 。(已知:CH3COOH的电离常数Ka=1.9×10-5)
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用___________ 作指示剂。
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显少于后两次,其原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=___________ mol/L。
(1)下列哪些措施能够使醋酸溶液中
 增大___________。
增大___________。| A.升温 | B.通入HCl气体 | C.加入NaHSO4固体 | D.加入NaOH固体 |
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中:
 =18,则此时溶液的pH=
=18,则此时溶液的pH=(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 24.72 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=
您最近一年使用:0次
名校
4 . 亚磷酸H3PO3是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
(1)设计实验证明H3PO3的酸性比碳酸强:________ 。
(2)常温下,已知H3PO3溶液中含磷粒子的浓度之和为0.1mol·L-1,溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示。

① 随溶液pH的变化用曲线
随溶液pH的变化用曲线________ (填“1”、“2”或“3”)表示。
②反应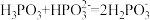 的平衡常数K=
的平衡常数K=________ 。
(1)设计实验证明H3PO3的酸性比碳酸强:
(2)常温下,已知H3PO3溶液中含磷粒子的浓度之和为0.1mol·L-1,溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示。

①
 随溶液pH的变化用曲线
随溶液pH的变化用曲线②反应
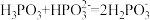 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
5 . 常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
(1)温度升高, 的电离平衡向
的电离平衡向_______ (填“左”或“右”)移动,能支持该结论的表中数据是_______ (填字母)。
A.电离常数 B.电离度 C. D.
D.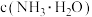
(2)表中 基本不变的原因是
基本不变的原因是_______ 。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
(4)氨水溶液中,下列做法能使 与
与 比值变大的是
比值变大的是_______ 。
A.加入固体氯化铵 B.通入少量氯化氢 C.加入少量固体氢氧化钠
| 温度/℃ |  | 电离常数 | 电离度/% |  |
| 0 | 16.56 | 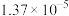 | 9.098 | 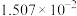 |
| 10 | 15.16 | 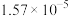 | 10.18 | 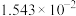 |
| 20 | 13.63 | 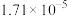 | 11.2 | 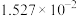 |
 的电离平衡向
的电离平衡向A.电离常数 B.电离度 C.
 D.
D.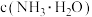
(2)表中
 基本不变的原因是
基本不变的原因是(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
A.溶液的 增大 增大 | B.氨水的电离度减小 |
C. )减小 )减小 | D. 减小 减小 |
 与
与 比值变大的是
比值变大的是A.加入固体氯化铵 B.通入少量氯化氢 C.加入少量固体氢氧化钠
您最近一年使用:0次
6 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s) Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:
①37℃时,Ka(HUr)=4×10−6,Kw=2.4×10−14,Ksp(NaUr)=6.4×10−5
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10−4mol∙L−1
(1)尿酸电离方程式为___________
(2)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液当中c(Na+)___________ c(Ur−)(填“>”、“<”或“=”),写出溶液中电荷守恒的等式:___________ 。
(3)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+)=0.2mol∙L−1时,通过计算溶液Q=c(Na+)∙c(Ur-)=___________ 。判断是否有NaUr晶体析出___________ (填是/否)。
(4)对于尿酸偏高的人群,下列建议正确的是___________ 。
a.加强锻炼,注意关节保暖
b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂
d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:
①37℃时,Ka(HUr)=4×10−6,Kw=2.4×10−14,Ksp(NaUr)=6.4×10−5
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10−4mol∙L−1
(1)尿酸电离方程式为
(2)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液当中c(Na+)
(3)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+)=0.2mol∙L−1时,通过计算溶液Q=c(Na+)∙c(Ur-)=
(4)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖
b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂
d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
7 . 25℃时,三种酸的电离平衡常数如下表所示。
(1)将pH和体积均相同的 溶液和HF溶液分别稀释,其pH随加水体积的变化如图所示,曲线I是
溶液和HF溶液分别稀释,其pH随加水体积的变化如图所示,曲线I是_____________ 的pH变化情况。

(2)0.1 的
的 溶液和0.1
溶液和0.1 的NaF溶液中,
的NaF溶液中,
______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)草酸 的表达式是:
的表达式是: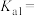
_____ ;在NaF溶液中滴加少量草酸溶液,发生反应的离子反应方程式为_____________ 。
(4)常温下测得0.1 的
的 的pH为4.8,则此
的pH为4.8,则此 溶液中
溶液中
_____  (填“大于小于”或“等于”)。
(填“大于小于”或“等于”)。
名称 | 醋酸 | 氢氟酸 | 草酸 |
化学式 |
| HF |
|
电离平衡常数 |
|
|
|
(1)将pH和体积均相同的
 溶液和HF溶液分别稀释,其pH随加水体积的变化如图所示,曲线I是
溶液和HF溶液分别稀释,其pH随加水体积的变化如图所示,曲线I是
(2)0.1
 的
的 溶液和0.1
溶液和0.1 的NaF溶液中,
的NaF溶液中,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)草酸
 的表达式是:
的表达式是: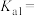
(4)常温下测得0.1
 的
的 的pH为4.8,则此
的pH为4.8,则此 溶液中
溶液中
 (填“大于小于”或“等于”)。
(填“大于小于”或“等于”)。
您最近一年使用:0次
8 . 常温下,有四种溶液:①0.1mol·L-1CH3COOH溶液②0.1mol·L-1CH3COONa溶液③0.1mol·L-1NaHSO3溶液④0.1mol·L-1NaHCO3溶液。
(1)溶液①的pH_______ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是_______ 。
(2)溶液②呈_______ (填“酸”“碱”或“中”)性。其原因是_______ (用离子方程式和适当的叙述说明)。
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)_______ (填“>”“<”或“=”,下同)c(SO ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3)_______ c(CO )。
)。
(1)溶液①的pH
(2)溶液②呈
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)
 ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3) )。
)。
您最近一年使用:0次
解题方法
9 . 常温下,向 溶液中滴加
溶液中滴加 溶液,滴定曲线及混合溶液中
溶液,滴定曲线及混合溶液中 [其中X表示
[其中X表示 或
或 ]随
]随 的变化如图所示。
的变化如图所示。

回答下列问题:
(1)
_______ ,X表示的是_______ 。
(2) 在水中的电离方程式为
在水中的电离方程式为_______ 。
(3)计算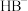 的电离常数
的电离常数
_______  。
。
(4)滴加 溶液至
溶液至 时,所得溶液中各离子浓度由大到小的顺序是
时,所得溶液中各离子浓度由大到小的顺序是_______ ;滴加 溶液至
溶液至 时,所得溶液中
时,所得溶液中
_______ 。
(5)恰好达滴定终点时,所得溶液的微粒浓度关系正确的是_______ (填字母标号)。
a.
b.
c.
 溶液中滴加
溶液中滴加 溶液,滴定曲线及混合溶液中
溶液,滴定曲线及混合溶液中 [其中X表示
[其中X表示 或
或 ]随
]随 的变化如图所示。
的变化如图所示。
回答下列问题:
(1)

(2)
 在水中的电离方程式为
在水中的电离方程式为(3)计算
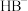 的电离常数
的电离常数
 。
。(4)滴加
 溶液至
溶液至 时,所得溶液中各离子浓度由大到小的顺序是
时,所得溶液中各离子浓度由大到小的顺序是 溶液至
溶液至 时,所得溶液中
时,所得溶液中
(5)恰好达滴定终点时,所得溶液的微粒浓度关系正确的是
a.

b.

c.

您最近一年使用:0次
名校
10 . 常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)浓度相同的① ;②
;② ;③
;③ 三种溶液的pH由小到大排列的顺序为(用编号填写)
三种溶液的pH由小到大排列的顺序为(用编号填写)___________ 。
(2)常温下0.1 mol∙L−1的 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
(3)反应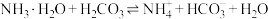 的平衡常数K=
的平衡常数K=______ (填准确数值)。
(4)25℃时, 与
与 的混合溶液,若测得混合液pH=6,则溶液中:
的混合溶液,若测得混合液pH=6,则溶液中: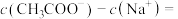
___________ (填准确数值)。
(5)简述 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
| 弱电解质 |  |  |  |
| 电离平衡常数 |  |  | 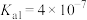  |
 ;②
;② ;③
;③ 三种溶液的pH由小到大排列的顺序为(用编号填写)
三种溶液的pH由小到大排列的顺序为(用编号填写)(2)常温下0.1 mol∙L−1的
 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。A. | B. | C. | D. |
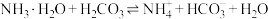 的平衡常数K=
的平衡常数K=(4)25℃时,
 与
与 的混合溶液,若测得混合液pH=6,则溶液中:
的混合溶液,若测得混合液pH=6,则溶液中: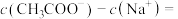
(5)简述
 溶液呈碱性的原因
溶液呈碱性的原因
您最近一年使用:0次
2023-03-20更新
|
252次组卷
|
3卷引用:四川省德阳市第五中学2022-2023学年高二下学期3月月考化学试题