名校
1 .  的水解反应方程式为:
的水解反应方程式为: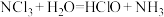 ,下列说法正确的是
,下列说法正确的是
 的水解反应方程式为:
的水解反应方程式为: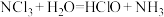 ,下列说法正确的是
,下列说法正确的是| A.元素第一电离能:O>N |
| B.氧原子的最高能级轨道形状为球形 |
C.基态氯原子的价电子轨道表示式为: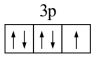 |
| D.元素的电负性:O>Cl |
您最近一年使用:0次
2022-01-21更新
|
315次组卷
|
4卷引用:山东省日照市2021-2022学年高二上学期期末考试化学试题
2 . “胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁( )等化合物。下列叙述错误的是
)等化合物。下列叙述错误的是
 )等化合物。下列叙述错误的是
)等化合物。下列叙述错误的是A.第一电离能: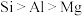 |
| B.基态铝原子核外电子占据的最高能级符号为3p |
C.元素的电负性: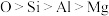 |
D.某同学书写的基态Mg原子的轨道表示式: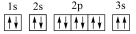 违反了泡利不相容原理 违反了泡利不相容原理 |
您最近一年使用:0次
2021-12-03更新
|
532次组卷
|
6卷引用:山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题
山东省日照市五莲县2021-2022学年高二上学期期中考试化学试题山东省日照市莒县、五莲县、岚山区2021-2022学年高二11月联合考试化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题广东省佛山市三水区华侨中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
3 . Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为anm。下列叙述正确的是

| A.电负性:Mg>Si |
| B.Mg核外电子有3种不同的运动状态 |
C.Mg与Si之间的最近距离为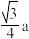 |
D.Mg2Si的密度计算式为 |
您最近一年使用:0次
2021-09-04更新
|
748次组卷
|
5卷引用:山东省日照市五莲中学2023-2024学年高二3月月考化学试题
解题方法
4 . 非金属元素及其化合物在生产、生活中占据重要地位。回答下列问题:
(1)基态Se原子核外电子占据的最高能级符号为____ ,该能级的电子云轮廓图形为_____ 形。
(2)H2O、H2S、H2Se的沸点由高到低的顺序为_____ (填化学式,下同),酸性由强到弱的顺序为______ 。
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是_______ (填标号)。
a.SO2 b.CS2 c.OF2 d.NO
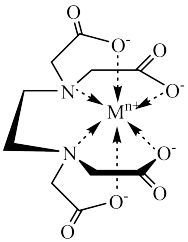
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为_____ ,EDTA中C原子的杂化方式为_____ ,1molEDTA通过螯合作用形成了_____ mol五元环。
(1)基态Se原子核外电子占据的最高能级符号为
(2)H2O、H2S、H2Se的沸点由高到低的顺序为
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是
a.SO2 b.CS2 c.OF2 d.NO

(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为

您最近一年使用:0次
5 . 用于检测室内空气中甲醛含量的一种常见试剂MBTH的结构如图所示。下列关于该材料组成元素的说法正确的是


| A.4种元素的电负性:N>S>C>H |
| B.4种元素均位于p区 |
C.基态C原子的轨道表示式为 |
| D.基态S原子核外有16种空间运动状态 |
您最近一年使用:0次
2021-05-26更新
|
250次组卷
|
2卷引用:山东省日照市莒县2020-2021学年高二下学期期中考试化学试题
解题方法
6 . 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是


| A.Y为O或S元素 |
| B.元素电负性的顺序为X>Y>Z |
| C.元素的第一电离能顺序Z>Y>X>W |
| D.对应简单离子的半径顺序W>X>Y>Z |
您最近一年使用:0次
2021-05-07更新
|
359次组卷
|
2卷引用:山东省日照五莲县2020-2021学年高二下学期期中考试化学试题
解题方法
7 . 工业上以纯碱、水、二氧化硫为原料,利用“干法”工艺制备食品抗氧化剂焦亚硫酸钠(Na2S2O5)。
回答下列问题:
(1)原料涉及的元素中,电负性最大的是____ (填元素符号);纯碱中阴离子的中心原子杂化方式为____ 。
(2)二氧化硫易溶于水的原因除与水反应外,还有_____ ;与二氧化硫互为等电子体的阴离子有_______ (填化学式,写一种即可)。
(3)焦亚硫酸根的结构图为: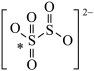 ,标有“*”的硫的化合价为
,标有“*”的硫的化合价为____ 。
(4)Na2S2O5加热至一定温度时分解为Na2O和SO2,Na2O晶胞为立方晶胞,结构如图,图中黑球代表阳离子,白球代表阴离子(NA为阿伏加德罗常数的值)。

①阴离子的配位数为___ 。
②若晶胞参数为a nm,则晶胞的密度为___ g·cm-3.(用含a、NA的式子表示)。
回答下列问题:
(1)原料涉及的元素中,电负性最大的是
(2)二氧化硫易溶于水的原因除与水反应外,还有
(3)焦亚硫酸根的结构图为:
 ,标有“*”的硫的化合价为
,标有“*”的硫的化合价为(4)Na2S2O5加热至一定温度时分解为Na2O和SO2,Na2O晶胞为立方晶胞,结构如图,图中黑球代表阳离子,白球代表阴离子(NA为阿伏加德罗常数的值)。

①阴离子的配位数为
②若晶胞参数为a nm,则晶胞的密度为
您最近一年使用:0次
8 . 研究K、Ca、Fe、As、T等第四周期元素对生产、生活有重要意义。回答下列问题:
(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为___ ,砷酸常用于制备颜料、砷酸盐、杀虫剂等,则AsO 的空间构型是
的空间构型是___ 。
(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
①Ti3+的电子排布式为___ 。
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为___ ,原因是___ 。
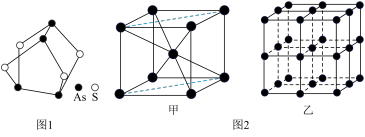
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是___ 。(填字母标号)假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___ g/cm3。(列式即可,设阿伏加 德罗常数的值为NA)


(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为
 的空间构型是
的空间构型是(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
①Ti3+的电子排布式为
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是

您最近一年使用:0次
解题方法
9 . 氮原子不但可以形成离子键,还可以形成σ键、π键、大π键和配位键等,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
(1)电负性:N_______ O(填“>” 或“<”),基态氮原子价电子排布图不是 ,是因为该排布方式违背了
,是因为该排布方式违背了_________ 。
(2)肼(H2N-NH2)分子中孤电子对与σ键的数目之比为__________ ,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是___________ 。
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①写出与Na3NO4的阴离子互为等电子体的一种阴离子:___________ (填化学式)。
②在573K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4,Na2O的立方晶胞如图所示。Na2O晶胞的参数为a pm,则晶胞密度为_______ g/cm3(列出计算式即可,NA为阿伏加 德罗常数的值)。

(1)电负性:N
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)肼(H2N-NH2)分子中孤电子对与σ键的数目之比为
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①写出与Na3NO4的阴离子互为等电子体的一种阴离子:
②在573K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4,Na2O的立方晶胞如图所示。Na2O晶胞的参数为a pm,则晶胞密度为

您最近一年使用:0次
10 . 叠氮化钠(NaN3)热分解可得纯N2,2NaN3(s)  2Na(l)+3N2(g),下列说法正确的是
2Na(l)+3N2(g),下列说法正确的是
 2Na(l)+3N2(g),下列说法正确的是
2Na(l)+3N2(g),下列说法正确的是A.NaN3中的阴离子( )与 )与 互为等电子体 互为等电子体 |
| B.NaN3与KN3结构类似,则前者晶格能较小 |
| C.N2常温下很稳定,是因为N的电负性大 |
| D.钠晶胞是体心立方结构,每个晶胞含有2个钠原子 |
您最近一年使用:0次



