名校
1 . 下列有关物质结构和性质的说法错误的是
| A.氯化钠焰色试验为黄色,与氯原子电子跃迁有关 |
| B.正戊烷沸点高于新戊烷,与分子间作用力有关 |
| C.三氟乙酸的酸性大于三氯乙酸,与羧基中的羟基极性有关 |
| D.I2在CCl4中的溶解度大于在水中的,与分子的极性有关 |
您最近一年使用:0次
2 . 常温下,在 (弱酸)溶液中滴加
(弱酸)溶液中滴加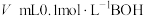 (弱碱)溶液生成强电解质
(弱碱)溶液生成强电解质 ,混合溶液中
,混合溶液中 与
与 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
 (弱酸)溶液中滴加
(弱酸)溶液中滴加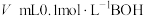 (弱碱)溶液生成强电解质
(弱碱)溶液生成强电解质 ,混合溶液中
,混合溶液中 与
与 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是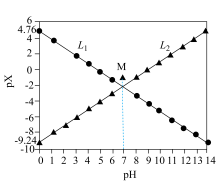
A. 代表 代表 与 与 的关系 的关系 |
B. 时达到 时达到 点, 点, 不水解 不水解 |
C.常温下, |
D.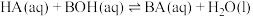 的平衡常数 的平衡常数 小于10000 小于10000 |
您最近一年使用:0次
名校
3 . 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子的核外电子占据3个能级且每个能级上电子数相等,基态C原子价层电子排布式为 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
(1)基态E原子有___________ 种运动状态不同的电子,D位于元素周期表___________ 区。
(2)在A、B、C、D的简单氢化物中,沸点最高的是___________ (填化学式,下同);键角最大的是___________ 。
(3) 分子中D的杂化类型是
分子中D的杂化类型是___________ ;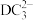 的空间结构为
的空间结构为___________ 。
(4)元素的基态气态原子得到一个电子形成 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:___________ 。
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为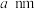 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为___________ ,该晶体密度为___________  。
。
 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:(1)基态E原子有
(2)在A、B、C、D的简单氢化物中,沸点最高的是
(3)
 分子中D的杂化类型是
分子中D的杂化类型是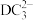 的空间结构为
的空间结构为(4)元素的基态气态原子得到一个电子形成
 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为
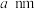 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为 。
。
您最近一年使用:0次
名校
解题方法
4 . 实验室制备配合物 的原理是
的原理是
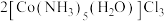 ,下列叙述错误的是
,下列叙述错误的是
 的原理是
的原理是
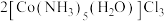 ,下列叙述错误的是
,下列叙述错误的是A. 的电子式为 的电子式为 |
B.基态N原子价层电子排布图为 |
C. 中 中 的配位数为6 的配位数为6 |
D.已知 为正八面体结构,则 为正八面体结构,则 有4种结构 有4种结构 |
您最近一年使用:0次
5 . 常温下,在特制容器中加入20mL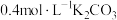 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
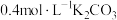 溶液,用
溶液,用 HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
HCl溶液滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是
A.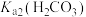 的数量级为 的数量级为 |
| B.滴定过程中,水的电离程度始终在减小 |
C.cd段反应的离子方程式为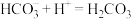 |
D.f点对应的溶液中存在: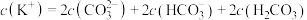 |
您最近一年使用:0次
2024-05-29更新
|
81次组卷
|
2卷引用:广西壮族自治区玉林市五校2023-2024学年高二下学期5月联考 化学试题
名校
6 . 化合物 是一种重要的药物中间体.其合成路线如图所示:
是一种重要的药物中间体.其合成路线如图所示:
(1)A的化学名称为__________ ,所含官能团的名称为__________ 。
(2)C→D反应的化学方程式为_________________________ ,该反应类型为__________ 。
(3) 中σ键和π键数目之比为
中σ键和π键数目之比为__________ 。
(4) 的同分异构体有多种,其中能发生银镜反应的芳香族化合物的同分异构体有
的同分异构体有多种,其中能发生银镜反应的芳香族化合物的同分异构体有__________ 种(不考虑立体异构,分子中不含有—O—O—结构)。
(5)M的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__________ (任写一种即可)。
①能与 溶液发生显色反应,分子中含有1个手性碳原子;②分子中有4种不同化学环境的氢。
溶液发生显色反应,分子中含有1个手性碳原子;②分子中有4种不同化学环境的氢。
(6)已知: ,写出以
,写出以 、
、 和
和 为原料制备的
为原料制备的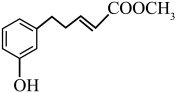 合成路线流程图:
合成路线流程图:______________________________ (其他无机试剂任用)。
 是一种重要的药物中间体.其合成路线如图所示:
是一种重要的药物中间体.其合成路线如图所示: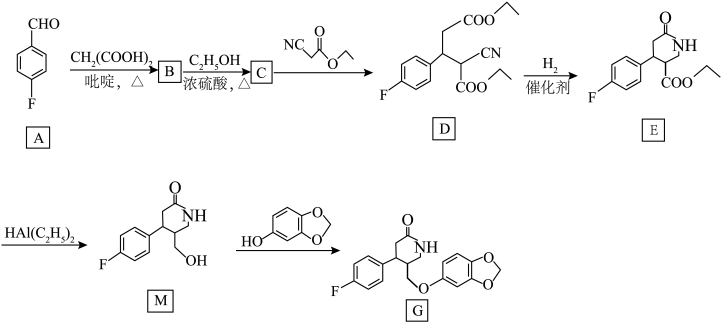
已知: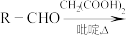
 ,R为烃基。
,R为烃基。
(1)A的化学名称为
(2)C→D反应的化学方程式为
(3)
 中σ键和π键数目之比为
中σ键和π键数目之比为(4)
 的同分异构体有多种,其中能发生银镜反应的芳香族化合物的同分异构体有
的同分异构体有多种,其中能发生银镜反应的芳香族化合物的同分异构体有(5)M的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能与
 溶液发生显色反应,分子中含有1个手性碳原子;②分子中有4种不同化学环境的氢。
溶液发生显色反应,分子中含有1个手性碳原子;②分子中有4种不同化学环境的氢。(6)已知:
 ,写出以
,写出以 、
、 和
和 为原料制备的
为原料制备的 合成路线流程图:
合成路线流程图:
您最近一年使用:0次
名校
7 . 橡胶工业的硫化剂二氯化二硫( ,沸点:
,沸点: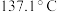 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: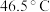 )与
)与 在
在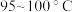 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: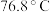 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略): ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。
回答下列问题:
(1)利用上述装置制备 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→____________ (填小写字母,仪器不重复使用)。
(2)装置 中生成
中生成 的化学方程式为
的化学方程式为________________________ 。
(3)仪器X的名称是____________________ ,试剂Y的名称是_______________ 。
(4)实验过程中仪器X中回流的主要物质是____________ (填化学式)。
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是_________________ 。
(6)本实验对于装置E,需考虑的因素是____________ (任写一种即可)。
(7) 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:_______________ 。
 ,沸点:
,沸点: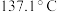 )是一种橙黄色液体,溶于
)是一种橙黄色液体,溶于 、
、 等,易水解,超过
等,易水解,超过 开始分解。可由
开始分解。可由 (沸点:
(沸点: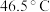 )与
)与 在
在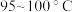 反应制备,同时有
反应制备,同时有 (沸点:
(沸点: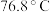 )生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):
)生成。实验装置(部分夹持仪器已省略)如图所示(E加热装置已省略):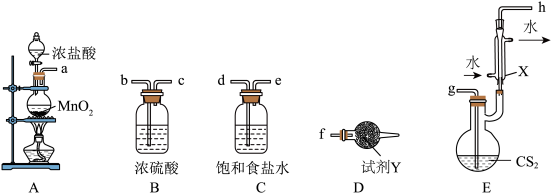
 ;
; 在
在 以上分解生成
以上分解生成 和
和 。
。回答下列问题:
(1)利用上述装置制备
 ,按气流从左到右的方向连接各仪器接口,正确的顺序是a→
,按气流从左到右的方向连接各仪器接口,正确的顺序是a→(2)装置
 中生成
中生成 的化学方程式为
的化学方程式为(3)仪器X的名称是
(4)实验过程中仪器X中回流的主要物质是
(5)已知减压条件下可降低液体沸点。实验完成后,对E中混合液选择减压蒸馏,其原因是
(6)本实验对于装置E,需考虑的因素是
(7)
 遇水水解时,产生能使品红溶液褪色的气体,写出
遇水水解时,产生能使品红溶液褪色的气体,写出 遇水反应的化学方程式:
遇水反应的化学方程式:
您最近一年使用:0次
2024-05-26更新
|
77次组卷
|
2卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
8 . 工业上,从铜镍矿(主要成分为铜氧化物、镍氧化物,含有 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下:
②当溶液中某离子浓度c≤10-5mol/L时,可认为该离子沉淀完全。
③
(1)基态 原子的价电子排布图为
原子的价电子排布图为___________ 。
(2)浸出过程中通入 的目的是
的目的是___________ 。
(3)萃取时发生反应: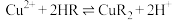 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。___________ 。
(4)写出用惰性电极电解 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:___________ 。
(5)黄钠铁矾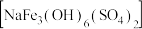 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是___________ 。
(6)第二次使用 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至___________ (保留2位小数)。
 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下: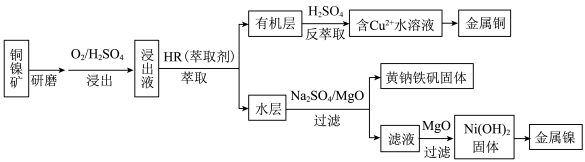
| 物质 |  |  |  |  |
 |  |  |  | 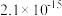 |
③

(1)基态
 原子的价电子排布图为
原子的价电子排布图为(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
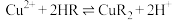 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。①某种 的结构简式为
的结构简式为 ,该分子中可能与
,该分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)写出用惰性电极电解
 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:(5)黄钠铁矾
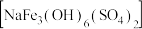 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是(6)第二次使用
 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至
您最近一年使用:0次
名校
解题方法
9 . 水杨酸异戊酯( ,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
②按照下图搭建反应装置,在145~155℃油浴下加热回流至不再有水生成。
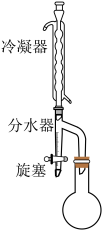
④干燥、减压蒸馏有机层,收集到31.2g产物。
⑤用红外光谱仪和核磁共振仪对产物进行表征。
已知:
①环己烯(沸点83℃)可与水形成沸点为70℃的共沸物。
②沸点:水杨酸211℃、异戊醇131℃、环己烯83℃、水杨酸异戊酯282℃。
回答以下问题:
(1)反应中浓硫酸的作用是吸水剂和
(2)写出制备水杨酸异戊酯的化学方程式
(3)步骤②中表明反应中不再有水生成的现象是
(4)洗涤反应液时需要使用的主要仪器是
(5)步骤③中NaHCO3溶液的作用是
(6)本次实验的产率为
(7)红外光谱图中可获得产物信息包括
a.产物中碳氧双键键长 b.产物相对分子质量
c.产物中含有酯基结构 d.产物中氧元素质量分数
您最近一年使用:0次
名校
10 . 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①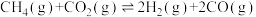

②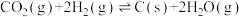
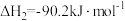
③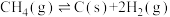
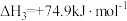
④
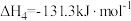
回答下列问题:
(1)
_______ ,该反应在___________ (填“高温”或“低温”或“任意温度”)下可自发进行。
(2)反应体系总压强分别为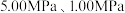 和
和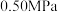 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为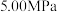 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。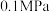 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为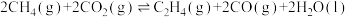 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为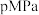 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,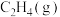 的平衡分压为
的平衡分压为____ Mpa(用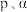 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
_____ 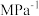 。
。
(5)CH4过光电化学转化可制得乙二醇,以乙二醇为燃料的燃料电池工作时,若以 溶液为电解液,则该电极的电极反应式为
溶液为电解液,则该电极的电极反应式为___________ 。
①
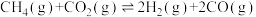

②
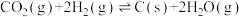
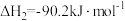
③
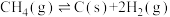
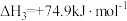
④

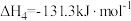
回答下列问题:
(1)

(2)反应体系总压强分别为
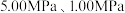 和
和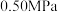 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为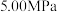 的曲线是
的曲线是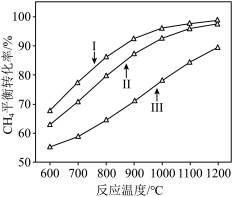
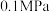 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是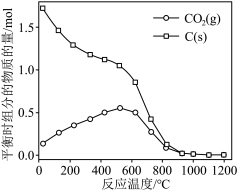
 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为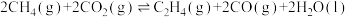 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为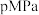 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,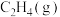 的平衡分压为
的平衡分压为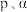 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
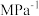 。
。(5)CH4过光电化学转化可制得乙二醇,以乙二醇为燃料的燃料电池工作时,若以
 溶液为电解液,则该电极的电极反应式为
溶液为电解液,则该电极的电极反应式为
您最近一年使用:0次



