名校
解题方法
1 . 漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如图:

下列说法不正确的是

下列说法不正确的是
| A.①中阴极的电极反应式为2Cl--2e-=Cl2↑ |
| B.②中反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O |
| C.上述过程涉及氧化还原反应、化合反应、复分解反应 |
| D.制备漂白粉过程中,Cl2转化为Ca(ClO)2时,Cl的原子利用率为100% |
您最近一年使用:0次
2020-10-21更新
|
318次组卷
|
3卷引用:山东省临沂第一中学2020-2021学年高三上学期第一次检测化学试题
山东省临沂第一中学2020-2021学年高三上学期第一次检测化学试题山东省莱芜一中2021届高三第一次考试化学试题(已下线)专题11 富集在海水中的元素——氯 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练
名校
解题方法
2 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生Na2O、N2和O2,其水溶液呈碱性,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2。回答下列问题:
(1)下列方法不能用来区分固体NaNO2和NaCl的是________ (填序号)。
A.分别溶于水
B.分别溶于水并滴加HNO3酸化的AgNO3溶液
C.分别加强热并收集气体检验
D.用筷子分别蘸取固体品尝味道
(2)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列________ (填序号)反应中H2O2表现出的性质相同。
A.2H2O2 2H2O+O2↑
2H2O+O2↑
B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4 +6HCl=2MnCl2 +2KCl+5O2↑+8H2O
服用维生素C可解毒,维生素C的作用是______ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”)。
(3)亚硝酸钠受热分解的化学方程式为4NaNO2 2Na2O+2N2↑+3O2↑,若反应中12.4gNa2O固体生成,则转移电子的物质的量为
2Na2O+2N2↑+3O2↑,若反应中12.4gNa2O固体生成,则转移电子的物质的量为 ______ mol。
(4)可用Cl2将溶液中的NO 氧化为NO
氧化为NO ,同时生成Cl-,该反应的离子方程式为:
,同时生成Cl-,该反应的离子方程式为:_____ 。
(1)下列方法不能用来区分固体NaNO2和NaCl的是
A.分别溶于水
B.分别溶于水并滴加HNO3酸化的AgNO3溶液
C.分别加强热并收集气体检验
D.用筷子分别蘸取固体品尝味道
(2)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列
A.2H2O2
 2H2O+O2↑
2H2O+O2↑ B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4 +6HCl=2MnCl2 +2KCl+5O2↑+8H2O
服用维生素C可解毒,维生素C的作用是
(3)亚硝酸钠受热分解的化学方程式为4NaNO2
 2Na2O+2N2↑+3O2↑,若反应中12.4gNa2O固体生成,则转移电子的物质的量为
2Na2O+2N2↑+3O2↑,若反应中12.4gNa2O固体生成,则转移电子的物质的量为 (4)可用Cl2将溶液中的NO
 氧化为NO
氧化为NO ,同时生成Cl-,该反应的离子方程式为:
,同时生成Cl-,该反应的离子方程式为:
您最近一年使用:0次
2020-10-10更新
|
59次组卷
|
3卷引用:山东省临沂第十九中学2021-2022学年高一上学期第二次段考化学试题
名校
解题方法
3 . 如图为“一些物质与水“的分类图,利用化合价和物质类别测物质的性质是化学研究的重要手段

已知: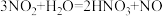
(1)从化学反应类型的角度可以将物质分类。将上述物质分为A、B两组的依据是_______ 、C组物质与水反应时水既不是氧化剂又不是还原剂,则D组物质为__________ 。
(2)从化合价的角度可以预测Na202的性质。
①Na2O2的性质________________ (填序号)。
a.只有氧化性b.只有还原性c既有氧化性又有还原性
②Na2O2以氧化性为主,Na2O2加入含有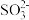 的溶液中反应结束后,硫元素存在形式合理的是
的溶液中反应结束后,硫元素存在形式合理的是___________ (填序号)。
a.S2-b.S C.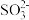 d.
d.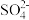
(3)从物质分类的角度可以推测物质的性质。化工生产中常常用到"三酸两碱”、“三酸“指硝酸、硫酸和盐酸,“两碱“指烧碱和纯碱。
①从物质分类角度看,不恰当的一种物质是_____________________ (填化学式)。
②“三酸”中一种酸的浓溶液能与氯酸钾反应得到黄绿色气体,该反应的离于方程式为_______________________________________________________ 。

已知:
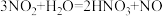
(1)从化学反应类型的角度可以将物质分类。将上述物质分为A、B两组的依据是
(2)从化合价的角度可以预测Na202的性质。
①Na2O2的性质
a.只有氧化性b.只有还原性c既有氧化性又有还原性
②Na2O2以氧化性为主,Na2O2加入含有
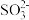 的溶液中反应结束后,硫元素存在形式合理的是
的溶液中反应结束后,硫元素存在形式合理的是a.S2-b.S C.
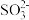 d.
d.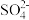
(3)从物质分类的角度可以推测物质的性质。化工生产中常常用到"三酸两碱”、“三酸“指硝酸、硫酸和盐酸,“两碱“指烧碱和纯碱。
①从物质分类角度看,不恰当的一种物质是
②“三酸”中一种酸的浓溶液能与氯酸钾反应得到黄绿色气体,该反应的离于方程式为
您最近一年使用:0次
2020-09-19更新
|
205次组卷
|
3卷引用:山东省临沂市2019~2020学年高一上学期期中化学学科学分认定考试化学试题
4 . 高铁酸钾纯品为暗紫色有光泽粉末。在198  以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是
 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是A.由上述反应可知,Fe(OH)3的氧化性强于 |
| B.高铁酸钾中铁显 + 6价 |
| C.上述反应氧化剂和还原剂的物质的量之比为3 : 2 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2020-06-22更新
|
215次组卷
|
4卷引用:山东省临沂市莒南第二中学2021届高三10月月考化学试题
山东省临沂市莒南第二中学2021届高三10月月考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)
5 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系
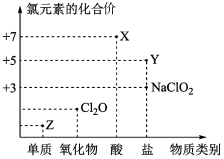
回答下列问题:
(1)X的电离方程式为________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为__ ;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别__ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的__ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为__ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近一年使用:0次
6 . 二氧化氯(ClO2,黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。其一种生产工艺如图所示。下列说法正确的是


| A.气体A为Cl2 |
| B.参加反应的NaClO2和NCl3的物质的量之比为3:1 |
| C.溶液B中含有大量的Na+、Cl-、OH- |
| D.可将混合气通过饱和食盐水除去C1O2中的NH3 |
您最近一年使用:0次
2020-05-01更新
|
283次组卷
|
2卷引用:山东省临沂市2020届高三下学期4月一模考试化学试题
解题方法
7 . 硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___ 。
 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___ 。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___ 。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
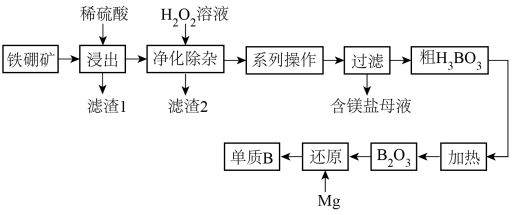
已知:
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为___ 。
 滤渣1的主要成分为
滤渣1的主要成分为___ 。
 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为___ ,然后再调节溶液的pH≈5.0的目的是___ 。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___ (填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___ 。
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为
 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:

已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的PH | 2.7 | 3.1 |
| 沉淀完全的PH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为
“浸出”时,将铁硼矿石粉碎的目的为 滤渣1的主要成分为
滤渣1的主要成分为 “净化除杂”时需先加H2O2溶液,其目的为
“净化除杂”时需先加H2O2溶液,其目的为 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用
您最近一年使用:0次
解题方法
8 . 连二亚硫酸钠(Na2S2O4)广泛用于纺织工业的还原性染色,是最适合木浆造纸的漂白剂。
(1)连二亚硫酸钠溶液暴露于空气中易吸收氧气而被氧化生成一种酸式盐,该反应的化学方程式为_______________ 。
(2)用甲酸钠(HCOONa)生产连二亚硫酸钠的工艺流程如下:

①该工艺中可以循环利用的物质是_________ (填名称);“一系列操作”包括__________ 。
②“反应”在70℃条件下进行,最佳加热方法是_____________ ,写出“反应”中发生反应的化学方程式:___________________ 。
③在包装、保存连二亚硫酸钠时加入少量的Na2CO3固体,据此可推测连二亚硫酸钠具有的性质是_____________ (填字母)。
A.在碱性介质中较稳定 B.具有极强的氧化性
(1)连二亚硫酸钠溶液暴露于空气中易吸收氧气而被氧化生成一种酸式盐,该反应的化学方程式为
(2)用甲酸钠(HCOONa)生产连二亚硫酸钠的工艺流程如下:

①该工艺中可以循环利用的物质是
②“反应”在70℃条件下进行,最佳加热方法是
③在包装、保存连二亚硫酸钠时加入少量的Na2CO3固体,据此可推测连二亚硫酸钠具有的性质是
A.在碱性介质中较稳定 B.具有极强的氧化性
您最近一年使用:0次
9 . SiH4易自燃,但它可用作除去二氧化碳、制取金刚砂等的试剂。
(1)1956年,英国标准电讯实验所成功研发出了硅烷(SiH4)热分解制备多晶硅的方法:SiH4(g) Si(s)+2H2(g)△H=-34.4kJ·mol-1。T℃时,向一体积为1L的恒容密闭容器中通入1mol硅烷发生上述反应。
Si(s)+2H2(g)△H=-34.4kJ·mol-1。T℃时,向一体积为1L的恒容密闭容器中通入1mol硅烷发生上述反应。
①达到平衡后,升高温度,平衡______ (填“正向”或“逆向”)移动;其他条件不变,再充入一定量的硅烷,硅烷的热分解率_____ (填“增大”“减小”或“不变”)。
②T℃时反应达到平衡,生成14.0g硅单质,该反应的化学平衡常数K=______ 。
(2)①利用SiH4除去二氧化碳,这是一种“变废为宝”制取CH3OH的新方法,试写出SiH4和二氧化碳、水(催化剂存在下)作用生成CH3OH和另一种常见原子晶体的化学方程式:_______ 。
②甲醇也可采用煤的气化、液化制取(CO+2H2 CH3OH),其中CO和H2还可用天然气来制取:CO2(g)+CH4(g)
CH3OH),其中CO和H2还可用天然气来制取:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol· L-1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强p1
2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol· L-1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强p1_____ (选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)_____ (选填“大于”“小于”或“等于”)v(逆)。

(3)SiH4与CH4在一定条件下反应制得的金刚砂(SiC)纯度高,其主要理由是___________ 。
(1)1956年,英国标准电讯实验所成功研发出了硅烷(SiH4)热分解制备多晶硅的方法:SiH4(g)
 Si(s)+2H2(g)△H=-34.4kJ·mol-1。T℃时,向一体积为1L的恒容密闭容器中通入1mol硅烷发生上述反应。
Si(s)+2H2(g)△H=-34.4kJ·mol-1。T℃时,向一体积为1L的恒容密闭容器中通入1mol硅烷发生上述反应。①达到平衡后,升高温度,平衡
②T℃时反应达到平衡,生成14.0g硅单质,该反应的化学平衡常数K=
(2)①利用SiH4除去二氧化碳,这是一种“变废为宝”制取CH3OH的新方法,试写出SiH4和二氧化碳、水(催化剂存在下)作用生成CH3OH和另一种常见原子晶体的化学方程式:
②甲醇也可采用煤的气化、液化制取(CO+2H2
 CH3OH),其中CO和H2还可用天然气来制取:CO2(g)+CH4(g)
CH3OH),其中CO和H2还可用天然气来制取:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol· L-1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强p1
2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol· L-1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强p1
(3)SiH4与CH4在一定条件下反应制得的金刚砂(SiC)纯度高,其主要理由是
您最近一年使用:0次
2020-02-14更新
|
105次组卷
|
2卷引用:山东省临沂市2020届高三上学期期末考试化学试题
解题方法
10 . 活性炭吸附法是工业上提碘的方法之一,其流程如下:
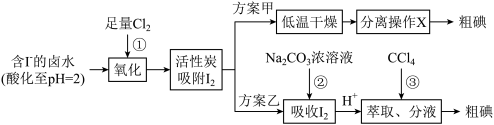
下列说法正确的是

下列说法正确的是
| A.反应①中氧化剂与还原剂物质的量之比为1:1 |
| B.分离操作X的名称是分液 |
| C.反应②是氧化还原反应 |
| D.加淀粉可检验分液后的水溶液中是否含有I- |
您最近一年使用:0次



