名校
解题方法
1 . 合成氨反应N2(g)+3H2(g) 2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
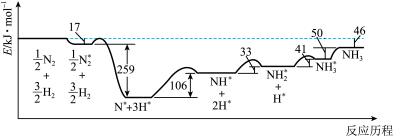
该历程中反应速率最慢的步骤的方程式为________ 。
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入 =3的混合气体,体系中各气体的含量与时间变化关系如图所示:
=3的混合气体,体系中各气体的含量与时间变化关系如图所示:

①以下叙述不能 说明该条件下反应达到平衡状态的是_________ (填字母)。
a.氨气的体积分数保持不变
b.容器中 保持不变
保持不变
c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.3v(H2)=v(N2)
②反应20min时达到平衡,则0~20min内v(H2)=________ MPa•min-1,该反应的Kp=_______ MPa-2(保留小数点后两位)。(Kp为以分压表示的平衡常数)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中_________ 点(填“d”“e”“f”或“g”)。
(3)氨化脱硝过程发生反应4NO(g)+4NH3(g)+O2(g)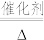 4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因_________ 。
(4)25℃用甲酸吸收氨气可得到HCOONH4溶液。已知:25℃时甲酸的Ka=1.75×10-5,NH3•H2O的Kb=2×10-5。则反应NH3•H2O+HCOOH HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=________ 。
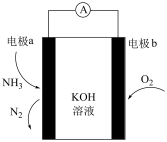
(5)化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图NH3如图。电极a上的电极反应式为:________ 。
 2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。

该历程中反应速率最慢的步骤的方程式为
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入
 =3的混合气体,体系中各气体的含量与时间变化关系如图所示:
=3的混合气体,体系中各气体的含量与时间变化关系如图所示:
①以下叙述
a.氨气的体积分数保持不变
b.容器中
 保持不变
保持不变c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.3v(H2)=v(N2)
②反应20min时达到平衡,则0~20min内v(H2)=
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中
(3)氨化脱硝过程发生反应4NO(g)+4NH3(g)+O2(g)
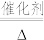 4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
4N2(g)+6H2O(g) △H<0,分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
(4)25℃用甲酸吸收氨气可得到HCOONH4溶液。已知:25℃时甲酸的Ka=1.75×10-5,NH3•H2O的Kb=2×10-5。则反应NH3•H2O+HCOOH
 HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=(5)化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图NH3如图。电极a上的电极反应式为:

您最近一年使用:0次
2023-10-17更新
|
209次组卷
|
3卷引用:河南省南阳市第一中学校2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
2 . 反应 在四种不同情况下的反应速率最慢的是
在四种不同情况下的反应速率最慢的是
 在四种不同情况下的反应速率最慢的是
在四种不同情况下的反应速率最慢的是A. |
B. |
C. |
D.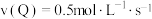 |
您最近一年使用:0次
2023-10-16更新
|
429次组卷
|
6卷引用:河南省洛阳市强基联盟2023-2024学年高二上学期10月联考化学试题
名校
3 . 将0.4 mol  气体充入2 L容积固定的密闭容器中发生反应:
气体充入2 L容积固定的密闭容器中发生反应:
 。在
。在 和
和 时,测得
时,测得 的物质的量随时间的变化如图1所示。在温度为
的物质的量随时间的变化如图1所示。在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化的曲线如图2所示。
的体积分数随压强变化的曲线如图2所示。

下列叙述中正确的有
① ;②
;② 时,40~80s内用
时,40~80s内用 表示的平均反应速率为0.15 mol⋅L
表示的平均反应速率为0.15 mol⋅L ⋅min
⋅min ;③A、C两点的反应速率:A<C;④A、C两点气体的颜色:A浅,C深;⑤A、B两点
;③A、C两点的反应速率:A<C;④A、C两点气体的颜色:A浅,C深;⑤A、B两点 的转化率:A>B;⑥A、B、C三点的平衡常数:
的转化率:A>B;⑥A、B、C三点的平衡常数: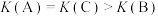
 气体充入2 L容积固定的密闭容器中发生反应:
气体充入2 L容积固定的密闭容器中发生反应:
 。在
。在 和
和 时,测得
时,测得 的物质的量随时间的变化如图1所示。在温度为
的物质的量随时间的变化如图1所示。在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化的曲线如图2所示。
的体积分数随压强变化的曲线如图2所示。
下列叙述中正确的有
①
 ;②
;② 时,40~80s内用
时,40~80s内用 表示的平均反应速率为0.15 mol⋅L
表示的平均反应速率为0.15 mol⋅L ⋅min
⋅min ;③A、C两点的反应速率:A<C;④A、C两点气体的颜色:A浅,C深;⑤A、B两点
;③A、C两点的反应速率:A<C;④A、C两点气体的颜色:A浅,C深;⑤A、B两点 的转化率:A>B;⑥A、B、C三点的平衡常数:
的转化率:A>B;⑥A、B、C三点的平衡常数: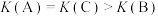
| A.六项 | B.五项 | C.四项 | D.三项 |
您最近一年使用:0次
2023-10-13更新
|
341次组卷
|
2卷引用:河南省南阳市第一中学校2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
4 . 丙烯在催化剂上选择性还原NO的反应为 。在三个2 L的恒容密闭容器中分别加入0.5 mol
。在三个2 L的恒容密闭容器中分别加入0.5 mol  和4.5 mol NO发生上述反应,实验测得三个容器中n(NO)随时间(t)的变化如图所示。下列说法错误的是
和4.5 mol NO发生上述反应,实验测得三个容器中n(NO)随时间(t)的变化如图所示。下列说法错误的是
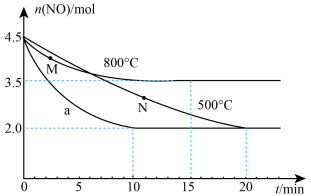
 。在三个2 L的恒容密闭容器中分别加入0.5 mol
。在三个2 L的恒容密闭容器中分别加入0.5 mol  和4.5 mol NO发生上述反应,实验测得三个容器中n(NO)随时间(t)的变化如图所示。下列说法错误的是
和4.5 mol NO发生上述反应,实验测得三个容器中n(NO)随时间(t)的变化如图所示。下列说法错误的是
| A.500℃条件下,曲线a所在的容器中使用了合适的催化剂 |
B.500℃条件下,20 min时达到平衡,则该容器中0~20min内用 表示的平均反应速率为 表示的平均反应速率为 |
C.正反应速率: |
| D.800℃条件下,混合气体的起始压强与平衡压强之比为90:91 |
您最近一年使用:0次
2023-10-11更新
|
620次组卷
|
4卷引用:河南省部分名校2023-2024学年高三上学期阶段性测试(二)化学试题
河南省部分名校2023-2024学年高三上学期阶段性测试(二)化学试题河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期11月月考化学试题(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建河北省沧州市2023-2024学年高三上学期期末联考化学试题
名校
5 . 1,3-丁二烯与HBr加成的能量—反应进程如图所示。已知0℃、短时间tmin内,amol的1,3-丁二烯与HBr完全反应得到3-溴-1-丁烯和1-溴-2-丁烯的物质的量之比为7:3。下列说法正确的是
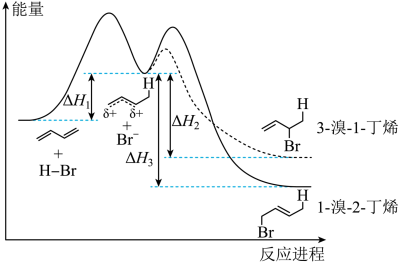

| A.反应时间越长,得到1-溴-2-丁烯的比例越大 |
B.tmin内生成1-溴-2-丁烯的平均速率为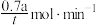 |
C.1,3-丁二烯与HBr反应生成3-溴-1-丁烯的反应热为 |
D. 与烯烃结合的第一步为决速步, 与烯烃结合的第一步为决速步, 进攻时活化能小的方向得到3-溴-1-丁烯 进攻时活化能小的方向得到3-溴-1-丁烯 |
您最近一年使用:0次
2023-10-10更新
|
244次组卷
|
2卷引用:河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题
名校
解题方法
6 . 某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g) cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
 cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
| A.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1 |
| B.12 s后,A的消耗速率等于B的生成速率 |
| C.化学计量数之比b∶c=2∶1 |
| D.12 s内,A和B反应放出的热量为0.4Q kJ |
您最近一年使用:0次
2023-10-09更新
|
445次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . 反应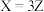 经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
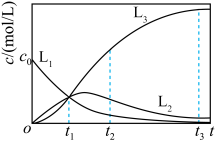
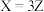 经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A. 为 为 随t的变化曲线 随t的变化曲线 |
B. 时, 时,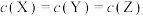 |
C. 时,X的消耗速率等于Z的生成速率 时,X的消耗速率等于Z的生成速率 |
D. 时, 时,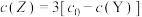 |
您最近一年使用:0次
2023-10-08更新
|
213次组卷
|
4卷引用:河南省部分名校2023-2024学年高二上学期10月月考化学试题
名校
解题方法
8 . 某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
(1)如图装置中盛放A溶液的仪器名称是___________ 。
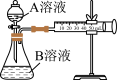
(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子反应方程式为___________ 。
(3)此实验探究的是________ 因素对化学反应速率的影响,若实验②在40s末收集了44.8mLCO2(标准状况下)则在40s内v( )=
)=___________ (忽略溶液混合前后体积的变化)。
(4)小组同学将上图的气体收集装置改为下图,实验完毕后,应先将气体冷却至室温,再___________ ,最后平视量气管刻度进行读数。为减小气体测量误差,还可以将量气管中的水换成___________ 。

(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定___________ 来比较化学反应速率。
(6)同学们在实验中发现反应速率总是如下图所示,探究时间内速率变快的主要原因可能是:________ 。
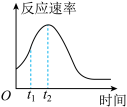
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol/LH2C2O4溶液 | 30mL0.2mol/LKMnO4溶液 |
| ② | 20mL溶液0.2mol/LH2C2O4溶液 | 30mL0.2mol/LKMnO4溶液 |
(1)如图装置中盛放A溶液的仪器名称是

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子反应方程式为
(3)此实验探究的是
 )=
)=(4)小组同学将上图的气体收集装置改为下图,实验完毕后,应先将气体冷却至室温,再

(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定
(6)同学们在实验中发现反应速率总是如下图所示,探究时间内速率变快的主要原因可能是:

A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大
您最近一年使用:0次
名校
9 . 治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理为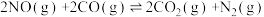 ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
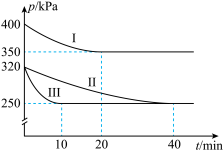
(1)实验Ⅱ从开始至达到平衡时的平均反应速率v(NO)=___________ 。
(2)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由分别为:
实验Ⅰ:___________ 。
实验Ⅲ:___________ 。
(3)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为___________ 。
(4)实验Ⅲ的平衡常数K=___________ 。
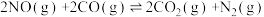 ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
(1)实验Ⅱ从开始至达到平衡时的平均反应速率v(NO)=
(2)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由分别为:
实验Ⅰ:
实验Ⅲ:
(3)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为
(4)实验Ⅲ的平衡常数K=
您最近一年使用:0次
10 . 为落实“双碳”目标,科学家对二氧化碳进行多方面的研究与利用。回答下列问题:
(1)用一种新型Zn-CO2水介质电池,能实现CO2转化为甲酸等。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时,负极反应为___________ ;当有1molCO2转化为HCOOH时,转移的电子数为___________ 。

(2)在催化剂存在条件下CO2与CH3CH3反应能制备CH2=CH2,从而实现CO2的利用,反应的化学方程式为 。下列说法正确的是___________(填字母标号)。
。下列说法正确的是___________(填字母标号)。
(3)在催化剂作用下,CO2(g)与H2(g)反应生成CH3OH(g)和H2O(g)。

①已知:373K时,相关物质的相对能量如图所示。该反应是___________ (填“放热”或“吸热”)反应,反应物与生成物的能量差为___________  。
。
②CO2与H2除生成CH3OH外,同时还发生下列副反应:
Ⅰ.
Ⅱ.
一定条件下,向容积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述三个反应,经过tmin达到平衡,此时容器中CH3OH(g)为amol,CO为bmol,H2O(g)的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),H2的平均反应速率为___________ 。
(1)用一种新型Zn-CO2水介质电池,能实现CO2转化为甲酸等。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时,负极反应为

(2)在催化剂存在条件下CO2与CH3CH3反应能制备CH2=CH2,从而实现CO2的利用,反应的化学方程式为
 。下列说法正确的是___________(填字母标号)。
。下列说法正确的是___________(填字母标号)。| A.反应中有2molC—H键断裂同时形成1molC=C键,反应达到平衡状态 |
| B.等温等容下,反应物各1mol反应达平衡与生成物各1mol反应达平衡时,两平衡体系压强相同 |
| C.以CH2=CH2为原料利用氯代乙醇法生产环氧乙烷时,原子利用率为100% |
| D.标准状况下,22.4LCO2参加反应转移2mol电子 |
(3)在催化剂作用下,CO2(g)与H2(g)反应生成CH3OH(g)和H2O(g)。

①已知:373K时,相关物质的相对能量如图所示。该反应是
 。
。②CO2与H2除生成CH3OH外,同时还发生下列副反应:
Ⅰ.

Ⅱ.

一定条件下,向容积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述三个反应,经过tmin达到平衡,此时容器中CH3OH(g)为amol,CO为bmol,H2O(g)的浓度为
您最近一年使用:0次



