名校
1 . 配平下列方程式:
(1)__ KMnO4+__ SO2+__ H2O→__ K2SO4+__ MnSO4+__ H2SO4
(2)__ CuS+__ HNO3→__ Cu(NO3)2+__ NO+__ H2SO4+__ H2O
(3)硝酸能将Na2SO3氧化为Na2SO4,本身被还原为NO,试写出化学方程式:_________ 。
(1)
(2)
(3)硝酸能将Na2SO3氧化为Na2SO4,本身被还原为NO,试写出化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液。某研究小组用该含碘废液制备NaI固体,实验流程如下:

已知:反应②2I−+2Cu2++SO32−+H2O=2CuI↓+SO42−+2H+
回答下列问题:
(1)产生含碘废液的离子方程式为____________________________________ 。
(2)①中I2与Na2SO3溶液反应的离子方程为_________________________________ 。
(3)③中CuI发生了_____ (填“氧化”或“还原”)反应,当有95.5gCuI参与反应,电子转移的数目为_______________ ,若还原产物只有NO2,写出该反应的化学方程式______________ 。
(4)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____________ 。
(5)反应⑤中生成黑色固体和无色无味能使澄清石灰水变浑浊的气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为_____________________________________________ 。

已知:反应②2I−+2Cu2++SO32−+H2O=2CuI↓+SO42−+2H+
回答下列问题:
(1)产生含碘废液的离子方程式为
(2)①中I2与Na2SO3溶液反应的离子方程为
(3)③中CuI发生了
(4)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为
(5)反应⑤中生成黑色固体和无色无味能使澄清石灰水变浑浊的气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是__________________________________ 。
②反应Ⅱ的离子方程式为__________________________________________________ 。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_______ 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知______ (填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为__________________ 。
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为__________________________________________________________ ,该电池总反应的离子方程式为___________________________________________________ 。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是
②反应Ⅱ的离子方程式为
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为
您最近一年使用:0次
名校
4 . H2O2既可以作氧化剂,又可以作还原剂。现向H2O2溶液中加入强酸酸化的KMnO4溶液,紫红色的KMnO4溶液变成了无色。该强酸性反应体系中,反应物和生成物共六种粒子:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。
(1)写出该反应离子方程式并配平:____________________________________________________________________ 。
(2)该反应应选择的酸是:________________ (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目__________________ 。

(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为_________ L。
(1)写出该反应离子方程式并配平:
(2)该反应应选择的酸是:
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目

(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
5 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:___ NaNO2+___ HI ═___ NO↑+___ I2 +___ NaI +___ H2O.
(1)配平上述化学方程式_______________ 。
(2)上述反应中氧化剂是____________ ;若有1mol 的还原剂被氧化,则反应中转移电子的数目是_____________
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl.,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:_____________ (填字母).
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用.NH4Cl ,能使NaNO2转化为不引起二次污染的N2,反应的离子方程式为:______________________ 。
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+_______ ____________________________________________________________ .若反应过程中转移5mol e-,则生成标准状况下N2的体积为_____________ L.
(1)配平上述化学方程式
(2)上述反应中氧化剂是
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl.,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用.NH4Cl ,能使NaNO2转化为不引起二次污染的N2,反应的离子方程式为:
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+
您最近一年使用:0次
2017-10-21更新
|
300次组卷
|
2卷引用:甘肃省白银市会宁县第一中学2018届高三上学期第二次月考理科综合化学试题
名校
解题方法
6 . 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
② Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O―→
H2O―→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________ 。
(2)上述反应①中氧化剂为______ ,被氧化的物质是______ 。若有2 mol Na2FeO2生成,则反应①中有________ mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________ (填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________ 。
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②
 Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O―→
H2O―→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH③Na2FeO2+Na2Fe2O4+2H2O
 Fe3O4+4NaOH
Fe3O4+4NaOH请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为
(2)上述反应①中氧化剂为
(3)关于“发蓝”的过程,下列说法不正确的是
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是
您最近一年使用:0次
2017-10-17更新
|
507次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题
名校
解题方法
7 . 汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑。对上述反应的描述错误的是
| A.NaN3是还原剂,KNO3是氧化剂 |
| B.该反应中有两种元素的化合价发生变化 |
| C.配平后物质的系数依次为 10、2、1、5、16 |
| D.若生成 8 mol N2,则转移电子的物质的量为 5 mol |
您最近一年使用:0次
2017-10-13更新
|
214次组卷
|
5卷引用:甘肃省临夏中学2018届高三上学期期中考试化学试题
甘肃省临夏中学2018届高三上学期期中考试化学试题陕西省西安中学2018届高三10月月考化学试题陕西省西安中学2018届高三上学期期中考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练山西省实验中学2018届高三上学期学业质量监测化学试题
8 . X、Y、Z是中学化学常见的三种元素,其中,X、Z位于短周期.常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13.请回答下列问题:
(1)X单质是______ ,Y离子是______ ,Z元素是______ 。(用元素符号或化学式填空)
(2)Z单质与Y的高价氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是_____________________________________ 。
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:

①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol 电子时,有______ molCr2O72-转化(计算结果保留两位小数)。
②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是_______________________________________ (用文字和化学用语表示)。
③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是______________________________________________ 。
(1)X单质是
(2)Z单质与Y的高价氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应化学方程式是
(3)含上述元素的某些物质常用于处理工业废水,部分流程如图1:

①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1mol 电子时,有
②含Z化合物可以使水中悬浮颗粒发生凝聚,原因是
③处理含氰废水时,CN-最终转化为两种无毒的气体,该反应的离子方程式是
您最近一年使用:0次
2017-09-25更新
|
236次组卷
|
2卷引用:甘肃省武威市第十八中学2018届高三上学期第一次诊断考试化学试题
名校
解题方法
9 . NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________ 。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
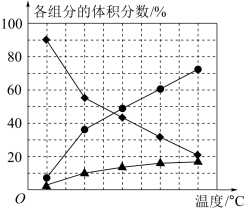
该反应的△H_____________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为________ 。
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
您最近一年使用:0次
2017-09-02更新
|
340次组卷
|
3卷引用:2017-2018学年甘肃省白银一中期中考试高三化学试卷
名校
10 . 下列过程中没有发生化学反应的是
| A.用石灰石来燃煤固硫 | B.用活性炭来吸附废水中的悬浮物 |
| C.实验室用H2O2和MnO2来制取O2 | D.光束通过Fe(OH)3 胶体时产生丁达尔效应 |
您最近一年使用:0次
2017-09-02更新
|
294次组卷
|
3卷引用:2017-2018学年甘肃省白银一中期中考试高三化学试卷



