名校
1 . 在KClO3+ 6HCl(浓)= KCl + 3Cl2↑ + 3H2O 的反应中,氧化剂和还原剂的物质的量之比是
| A.1:5 | B.1 :6 | C.5:1 | D.6:1 |
您最近半年使用:0次
2016-12-09更新
|
889次组卷
|
6卷引用:2015-2016学年甘肃省永昌一中高一上学期期末化学试卷
2 . 目前,我国采用“接触法”制硫酸,设备如图所示:
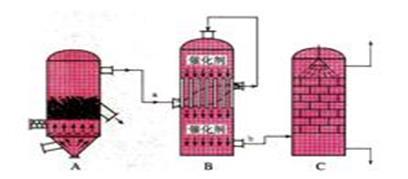
(1)图中设备A的名称是______________ ,该设备中主要反应的化学方程式为____________ 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________________
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是_______ 。

(1)图中设备A的名称是
(2)有关接触法制硫酸的下列说法中,不正确的是
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
| D.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是
您最近半年使用:0次
3 . 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸工厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________ ,AsH3的稳定性比NH3的稳定性_________ (填“强”或“弱”)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________ 。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。
①已知HCN为一元弱酸,则NaCN溶液的pH_______ 7(填“>”、“=”或“<”)。
②处理含CN -废水的方法之一是在微生物的作用下,CN -被氧气氧化成 ,同时生成NH3,该反应的离子方程式为
,同时生成NH3,该反应的离子方程式为________________ 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A—表示乳酸根离子)。
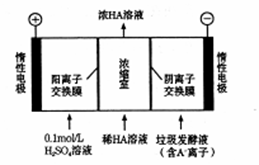
①阳极的电极反应式为_____________ 。
②简述浓缩室中得到浓乳酸的原理___________________________ 。
③电解过程中,采取一定的措施可控制阴极室的pH约为6~8,此时加入浓缩室的OH—可忽略不计。400mL10g/L的乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为____ L(乳酸的摩尔质量为90g/mol)。
(1)硫酸工厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。
①已知HCN为一元弱酸,则NaCN溶液的pH
②处理含CN -废水的方法之一是在微生物的作用下,CN -被氧气氧化成
 ,同时生成NH3,该反应的离子方程式为
,同时生成NH3,该反应的离子方程式为(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A—表示乳酸根离子)。

①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理
③电解过程中,采取一定的措施可控制阴极室的pH约为6~8,此时加入浓缩室的OH—可忽略不计。400mL10g/L的乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为
您最近半年使用:0次
解题方法
4 . 化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质,请按要求完成以下两个问题。
(1)配平酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
__ H2O2+ ___  +
+____ =__ Mn2++___ O2↑+__
(2)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:____________________ 、_______________________ 。
(1)配平酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
 +
+(2)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:
您最近半年使用:0次
5 . 铁屑可用于地下水脱氮,其实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5 mol/L盐酸中进行预处理。
Ⅱ、30 min后,用去离子水反复冲洗,至冲洗后液体的pH为中性。在N2保护下烘干备用。
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液。
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中。
请回答:
(1)盐酸溶解Fe2O3的离子方程式是__________ 。
(2)烘干时需要在N2保护下进行的原因是__________ 。
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是_________ 。
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整:________

Ⅰ、将铁屑浸泡在0.5 mol/L盐酸中进行预处理。
Ⅱ、30 min后,用去离子水反复冲洗,至冲洗后液体的pH为中性。在N2保护下烘干备用。
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液。
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中。
请回答:
(1)盐酸溶解Fe2O3的离子方程式是
(2)烘干时需要在N2保护下进行的原因是
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整:

您最近半年使用:0次
6 . A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是_______ ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:_______ 。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_______ 。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为_______ ,检查其中刺激性气体产物X的方法是_______ 。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_______ 。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是_______ mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为_______ 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______ 盐,X极易溶于水的原因是:_______ 。
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是
您最近半年使用:0次
名校
7 . 某离子反应涉及H2O、ClO-、NH4+ 、H+、N2、Cl-六种微粒。其中c(NH4+ )随反应进行逐渐减小。下列判断正确的是
| A.反应的还原产物是N2 |
| B.消耗1 mol氧化剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近半年使用:0次
2016-11-23更新
|
364次组卷
|
15卷引用:甘肃省白银市第十中学2019-2020学年高一上学期期中考试化学试题
甘肃省白银市第十中学2019-2020学年高一上学期期中考试化学试题2016届吉林省吉林大学附属中学高三上第四次摸底考试化学试卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2017届福建省泉州市南安一中高三上学期第一次阶段考化学试卷2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷陕西省西安中学2018届高三10月月考化学试题陕西省西安中学2018届高三上学期期中考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.4 氧化还原反应江西省上饶中学2019届高三上学期开学检测化学试题福建省晋江市季延中学2018-2019学年高二上学期开学考试化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题山西省运城市临猗中学2019届高三上学期第一次月考化学试题【校级联考】福建省泉州市永春县永春二中、永春五中2019届高三上学期期中联合考试化学试题辽宁省沈阳铁路实验中学2020届高三上学期开学考试化学试题陕西省黄陵中学2019-2020学年高一上学期期末考试化学试题(普通班)
8 . (1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
①加入铝粉的质量 克
②原硫酸铜溶液的物质的量浓度 mol/L
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
①加入铝粉的质量 克
②原硫酸铜溶液的物质的量浓度 mol/L
您最近半年使用:0次
名校
9 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中如右图所示:.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.下列说法中错误的是
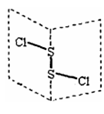

| A.S2Cl2的结构式为Cl-S-S-Cl |
| B.S2Cl2分子中既有有极性键又有非极性键 |
| C.反应中SO2是还原产物,S是氧化产物 |
| D.反应中,生成 1molSO2,转移电子为3mol |
您最近半年使用:0次
2016-04-20更新
|
912次组卷
|
11卷引用:2015-2016学年甘肃天水一中高一下第一次月考化学试卷
2015-2016学年甘肃天水一中高一下第一次月考化学试卷(已下线)2013届安徽省马鞍山市高中毕业班第一次教学质量检测理综化学试卷2016届湖南省衡阳市第八中学高三上学期第一次月考化学试卷2016届江西省吉安一中高三上学期期中测试化学试卷2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷2015-2016学年湖北省宜昌一中高二下3月月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题(已下线)练习15分子的结构与物质的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)广东省梅州市虎山中学、蕉岭中学、平远中学、宪梓中学四校2021-2022学年高二下学期5月联考化学试题
10 . 制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
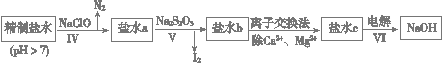
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:

① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
您最近半年使用:0次



