解题方法
1 . 【化学一选修2 :化学与技术】
工业上制取硝酸的主要流程图如图1所示,尾气处理流程图如图2所示:

请根据上述流程,结合所学知识回答:
(1)工业合成氨的原料是N2和H2,其中N2以空气为原料制取,方法是____________ 。H2可用等物质的量的水和天然气为原料在催化剂作用下高温制取,其化学方程式为________________ 。 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g) CO2(g)+H2(g)来实现。已知1100K时该反应的平衡常数K= 0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于
CO2(g)+H2(g)来实现。已知1100K时该反应的平衡常数K= 0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于______________ 。
(2)在合成氨的设备(合成塔)中,使用热交换器的目的是_________ 。往吸收塔通入过量空气的原因是______________ 。
(3)利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图2所示。已知NO和NO2按1:1通入碱液中生成亚硝酸盐。工艺流程2中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_________ ;滤渣可循环使用,滤渣的主要成分是____________ (填化学式)。该工艺需控制NO和NO2物质的量之比接近1:1。若n(NO):n(NO2)<1:1,则会导致__________________ 。
(4)工业上生产硝酸的过程中产生NOx,也可以用NH3在高温下催化还原法消除NOx对空气的污染。写出NH3与NOx反应的化学方程式__________________ 。
工业上制取硝酸的主要流程图如图1所示,尾气处理流程图如图2所示:

请根据上述流程,结合所学知识回答:
(1)工业合成氨的原料是N2和H2,其中N2以空气为原料制取,方法是
 CO2(g)+H2(g)来实现。已知1100K时该反应的平衡常数K= 0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于
CO2(g)+H2(g)来实现。已知1100K时该反应的平衡常数K= 0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于(2)在合成氨的设备(合成塔)中,使用热交换器的目的是
(3)利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图2所示。已知NO和NO2按1:1通入碱液中生成亚硝酸盐。工艺流程2中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是
(4)工业上生产硝酸的过程中产生NOx,也可以用NH3在高温下催化还原法消除NOx对空气的污染。写出NH3与NOx反应的化学方程式
您最近一年使用:0次
解题方法
2 . 某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(1)“酸浸”过程中主要反应的离子方程式为:_____________ 、________________ .
(2)“酸浸”时,提高浸出速率的具体措施有_________ 、_______ .(写出两个)
(3)“碱溶”的目的是_____________ .物质X的化学式为________ .
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:__________________ .
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是_______________ .

(1)“酸浸”过程中主要反应的离子方程式为:
(2)“酸浸”时,提高浸出速率的具体措施有
(3)“碱溶”的目的是
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是
您最近一年使用:0次
3 . ①用双线桥表示下列氧化还原反应电子转移______________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
②配平下列氧化还原反应方程式:
_____ KMnO4+_____ H2O2+_____ H2SO4﹣_____ K2SO4+_____ MnSO4+_____ O2↑+_____ H2O.
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
②配平下列氧化还原反应方程式:
您最近一年使用:0次
4 . 已知高温条件下2Al+Fe2O3=2Fe+Al2O3放出大量的热,可用于定向爆破和焊接铁轨。
(1)该反应中____________元素被氧化。
(2)标出该反应的电子转移方向和数目___________________。
(3)欲除去产物中的Al2O3,所加试剂是 ,该反应的离子方程式为 。
(1)该反应中____________元素被氧化。
(2)标出该反应的电子转移方向和数目___________________。
(3)欲除去产物中的Al2O3,所加试剂是 ,该反应的离子方程式为 。
您最近一年使用:0次
解题方法
5 . 【化学——选修2:化学与技术】
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:

(1)上述工艺用碱液洗涤的目的是___________ ,可能发生的反应有______________ (写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________ ;最后尾气主要成分是__________________ 。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________ 。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________ 。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________ 。
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:

(1)上述工艺用碱液洗涤的目的是
(2)上述合成工艺中采用循环喷射吸收合成,其目的是
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为
您最近一年使用:0次
2016-12-09更新
|
274次组卷
|
3卷引用:2016届甘肃省天水一中高三上学期期末理综化学试卷
解题方法
6 . 铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为______________________ ;高铁酸钠能用作新型净水剂的原理是____________________________ ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
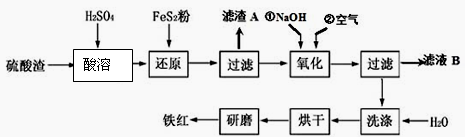
①酸溶过程中发生反应的化学方程式为___________ ,_____________ ,___________ ;“滤渣A”主要成分的化学式为_____________________ 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式_______________________________ ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为_____________ 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是____________ ,
如果pH过大,可能引起的后果是_____________________ 。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中发生反应的化学方程式为
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是
您最近一年使用:0次
2016-12-09更新
|
986次组卷
|
2卷引用:2016届甘肃省会宁一中高三上学期第四次月考理综化学试卷
解题方法
7 . 下列用来表示物质变化的反应式中,正确的是
| A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH- |
B.常温下,NaHCO3溶液显碱性:HCO3— + H2O  CO32—+ H3O+ CO32—+ H3O+ |
| C.氢氧化镁与稀硫酸反应: H++ OH— = H2O |
| D.硫酸亚铁酸性溶液中加入过氧化氢: Fe2+ + H2O2 + 2H+ = Fe3+ + 2H2O |
您最近一年使用:0次
2016-12-09更新
|
74次组卷
|
2卷引用:2015-2016学年甘肃省会宁一中高二上期末考试化学试卷
真题
解题方法
8 . 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第_____ 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为____ 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是_____ 。
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为___________ 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是______ (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为____________ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为____ L(标准状况)。
(1)原子序数为29的铜元素位于元素周期表中第
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2016-12-09更新
|
2064次组卷
|
3卷引用:甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题
解题方法
9 . 七水硫酸镁( MgSO4.7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣——硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(单位为g/l00g水)
硼镁泥制取七水硫酸镁的工艺流程如下:
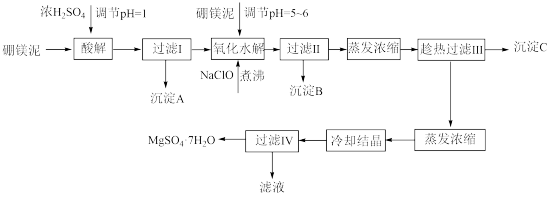
根据以上流程图并参考表格pH和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是___ (选填序号)。
a.被钝化 b.被氧化 c.被溶解
(2)过滤I的滤液中加入硼镁泥,调节溶液的pH =5—6,再加入NaClO溶液加热煮沸,其目的有:
①将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为____________ 。
②____________ ,该反应的离子反应方程式为___________ 。
(3)沉淀B中除MnO2、SiO2外还含有_______ 、_________ 等物质(填化学式)。
(4)沉淀C的化学式是__________ ,过滤Ⅲ需趁热过滤的理由是_____________ 。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |

根据以上流程图并参考表格pH和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是
a.被钝化 b.被氧化 c.被溶解
(2)过滤I的滤液中加入硼镁泥,调节溶液的pH =5—6,再加入NaClO溶液加热煮沸,其目的有:
①将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为
②
(3)沉淀B中除MnO2、SiO2外还含有
(4)沉淀C的化学式是
您最近一年使用:0次
名校
10 . 钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
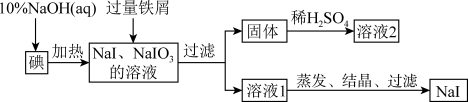
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
2016-12-09更新
|
915次组卷
|
6卷引用:2016届甘肃省天水一中高三上学期期末理综化学试卷



