名校
解题方法
1 . I.(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:__ KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)
①利用上述反应检验食盐中是否加碘,所需试剂是________ (填下列选项的序号)
A、碘水 B、KI溶液 C、淀粉溶液 D、稀硫酸 E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol则被氧化的NH3在标准状况下的体积为__________ L.
II.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol.L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④检漏、转移、洗涤⑤定容、摇匀。若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为___________ mL.
(2)实验时选用的仪器有___________ (填序号)
(3)配制过程中,下列情况会使配制结果偏高的是___________ (填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
①利用上述反应检验食盐中是否加碘,所需试剂是
A、碘水 B、KI溶液 C、淀粉溶液 D、稀硫酸 E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol则被氧化的NH3在标准状况下的体积为
II.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol.L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④检漏、转移、洗涤⑤定容、摇匀。若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为
(2)实验时选用的仪器有
(3)配制过程中,下列情况会使配制结果偏高的是
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
您最近一年使用:0次
2 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
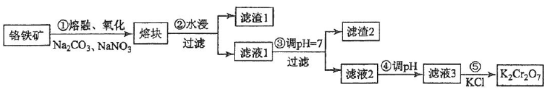
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________ 。该步骤不能使用陶瓷容器,原因是________________ 。
(2)滤渣1中含量最多的金属元素是____________ ,滤渣2的主要成分是_____________ 及含硅杂质。
(3)步骤④调滤液2的pH使之变____________ (填“大”或“小”),原因是___________________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
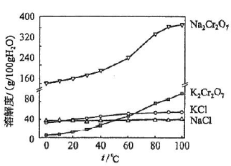
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________ 。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为
您最近一年使用:0次
2017-08-08更新
|
9584次组卷
|
21卷引用:甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题
甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)宁夏石嘴山市第三中学2018届高三上学期期末考试理综-化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】云南省弥勒市第二中学2020届高三上学期开学考试化学试题云南省南华县一中2020届高三上学期开学考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2019-2020学年人教版高中化学高考基础复习专题10《无机化学基础》测试卷贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届湖南省湘潭市高三教学质量监测卷化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题浙江省金华市东阳中学2019-2020学年高二下学期期中考试化学试题江西省景德镇市第一中学2021-2022学年高一上学期期中19班化学试题
解题方法
3 . S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生歧化反应,易溶于有机溶剂。实验室常用CS2与纯净的氯气制备S2C12。反应涉及到的几种物质的熔沸点如下:
实验室利用下列装置制备S2C12 (部分夹持仪器已略去):

回答下列问题:
(1)装置中b玻璃仪器的名称为_______ ;写出制备S2C12的化学方程式_______ 。
(2)整套装置装配完毕后,首先进行的操作是________ ,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________ 。装置A中反应的离子方程式是___________ 。
(4)D中采用热水浴加热的原因是__________ ,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________ 。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________ 。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________ 。
| 物质 | CS2 | Cl2 | CCl4 | S2C12 |
| 沸点/℃ | 47 | -34.6℃ | 77 | 137 |
| 熔点/℃ | -109 | -100.98℃ | -23 | -77 |

回答下列问题:
(1)装置中b玻璃仪器的名称为
(2)整套装置装配完毕后,首先进行的操作是
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是
(4)D中采用热水浴加热的原因是
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是
您最近一年使用:0次
4 . KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
(1) 请配平上述化学方程式。
(2) 浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3) 产生0.1mol Cl2,则转移的电子的物质的量为
(4) 氧化剂是
您最近一年使用:0次
解题方法
5 . 完成下列各题。
(1)制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为__________________ 。
(2)如果胃酸过多,可服用______________ (填写化学式)缓解症状,但如果患有胃溃疡,则不能服用,以防止胃穿孔。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为______________ 。
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式____________ 。
(1)制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为
(2)如果胃酸过多,可服用
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式
您最近一年使用:0次
2017-02-17更新
|
225次组卷
|
4卷引用:2014-2015甘肃省兰州一中高一上学期期末考试化学试卷
6 . 金属及其化合物在生产中用途广泛。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
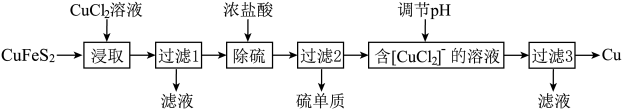
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为___________ 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为___________ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是___________ 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有____________ ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为____________ 。
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
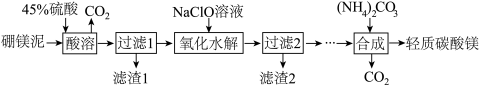
(5)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式_____________________ 。
(6)滤渣2的主要成分有MnO2和_____________ ,写出生成MnO2的离子方程式____________________ 。
(7)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是________________________ (只需写出相应的化学方程式)。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)过滤3所得滤液中可以循环使用的物质有
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(5)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式
(6)滤渣2的主要成分有MnO2和
(7)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是
您最近一年使用:0次
解题方法
7 . 高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:


(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_______________ 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________ (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为_____________________ 。
(4)已知:2NH4ClO4 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是_______________________ (填化学式)
②A、B、C中盛放的药品依次可以是__________ (选填:“I”“II”“III”)。
I.abd II.cbe III.bcf
(5)过滤用到的主要玻璃仪器是____________________ 。


(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为
(4)已知:2NH4ClO4
 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是
②A、B、C中盛放的药品依次可以是
I.abd II.cbe III.bcf
(5)过滤用到的主要玻璃仪器是
您最近一年使用:0次
2017-02-17更新
|
371次组卷
|
2卷引用:2017届甘肃省天水一中高三上学期12月月考化学卷
名校
8 . 实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)===KCl+MnCl2+Cl2↑+H2O (未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目____________ 。
(2)将上述配平的化学方程式改写为离子方程式______ 。
(3)浓盐酸在反应中显示出来的性质是______ 。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5 mol Cl2,则被氧化的HCl______ mol,转移的电子的数目约为______ 。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+______ =====Mn2++CO2↑+________ 完成上述离子方程式,此反应中,发生氧化反应的物质是______ ;若转移1 mol电子,生成标准状况下CO2___________ L。
KMnO4+HCl(浓)===KCl+MnCl2+Cl2↑+H2O (未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目
(2)将上述配平的化学方程式改写为离子方程式
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5 mol Cl2,则被氧化的HCl
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+
您最近一年使用:0次
2016-12-09更新
|
816次组卷
|
11卷引用:甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题
甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题2016-2017学年黑龙江哈尔滨师大附中高一上期中化学卷云南省丘北县第二中学2018-2019学年高一上学期10月月考化学试题【全国百强校】四川省棠湖中学2018-2019学年高一上学期期中考试化学试题云南省文山州马关县二中2018-2019学年 高一下学期6月份考试化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省昭通市巧家县二中2019-2020学年高一10月月考化学试题云南省施甸县第一中学2019-2020学年高一12月月考化学试题云南省马关县第二中学2019-2020学年高一上学期期末考试化学试题云南省玉龙纳西族自治县第一中学2021-2022学年高一上学期期末考试化学试题北京市中国人民大学附属中学2018-2019学年高一上学期期中考试化学试题
解题方法
9 . 已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有C1-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
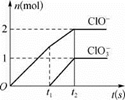
(1)t1前,氧化产物是__________ (填化学式)。
(2)t2时,Ca (OH)2与C12发生反应的总的离子方程式:_________ 。
(3)该石灰乳中含有Ca (OH)2的物质的量是__________ mol.
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是________ (填字母)。
(5)配平下列离子方程式:____ Fe(OH)3+ _____ C1O-+ ______ OH-=C1- +______ FeO4n-1+ ______ Cl-+_____ H2O。

(1)t1前,氧化产物是
(2)t2时,Ca (OH)2与C12发生反应的总的离子方程式:
(3)该石灰乳中含有Ca (OH)2的物质的量是
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是
| A.NaCl、C12 | B.NaCl、NaClO |
| C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
(5)配平下列离子方程式:
您最近一年使用:0次
解题方法
10 . 【化学---选修2:化学与技术】
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿 滤液A
滤液A Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+
ZnSO4、MnSO4溶液 Zn+MnO2+产品D
Zn+MnO2+产品D
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿
 滤液A
滤液A Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+
ZnSO4、MnSO4溶液
 Zn+MnO2+产品D
Zn+MnO2+产品D已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
您最近一年使用:0次



