名校
1 . 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
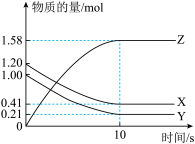
| A.反应开始到10s,用Z表示的反应速率为0.079mol/(L•s) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为39.5% |
| D.反应的化学方程式为:X(g)+Y(g)=2Z(g) |
您最近一年使用:0次
2024-01-16更新
|
384次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题
名校
2 . 关于工业合成氨反应: 。下列叙述错误的是
。下列叙述错误的是
 。下列叙述错误的是
。下列叙述错误的是A.在合成氨中,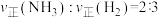 |
B.在恒温恒容下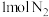 和 和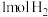 制 制 ,当 ,当 体积分数不变时达到平衡 体积分数不变时达到平衡 |
C.在恒温恒压下合成氨,平衡后通入少量氩气, 的平衡转化率不变 的平衡转化率不变 |
| D.在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率 |
您最近一年使用:0次
3 . 乙醇是重要的可再生能源,同时也是重要的有机化工原料。
I.我国科学家首次实现了二氧化碳一步近100%转化为乙醇:
 ,其反应历程如图所示:
,其反应历程如图所示:
_______ 。
(2)上述反应通常有副产物 存在,即发生副反应:
存在,即发生副反应: 。在不同温度下,若向1L某恒容密闭容器中充入
。在不同温度下,若向1L某恒容密闭容器中充入 和
和 发生上述反应,达到平衡时,测得
发生上述反应,达到平衡时,测得 的转化率与
的转化率与 的选择性随温度变化的结果如图所示(
的选择性随温度变化的结果如图所示( 的选择性
的选择性 )。
)。_______ 。
②T℃时,反应 的平衡常数为
的平衡常数为_______ (列出计算式即可)。
Ⅱ.CO也可用于制备乙醇: ,该反应也存在副反应:
,该反应也存在副反应: 。
。
(3)一定温度下,若向2L恒容密闭容器中通入2molCO(g)和 ,测得部分反应物与生成物的物质的量与时间的关系如图所示:
,测得部分反应物与生成物的物质的量与时间的关系如图所示:
_______ (填“大于”“小于”或“等于”) ;反应从开始到平衡,
;反应从开始到平衡, 的平均反应速率为
的平均反应速率为_______  。
。 的平衡转化率为
的平衡转化率为_______ 。
②不同的分子筛膜可选择性分离不同分子,若采用能分离水蒸气的分子筛,则对乙醇的选择性产生的影响是_______ (填“增大”“减小”或“不变”)。
I.我国科学家首次实现了二氧化碳一步近100%转化为乙醇:

 ,其反应历程如图所示:
,其反应历程如图所示:

(2)上述反应通常有副产物
 存在,即发生副反应:
存在,即发生副反应: 。在不同温度下,若向1L某恒容密闭容器中充入
。在不同温度下,若向1L某恒容密闭容器中充入 和
和 发生上述反应,达到平衡时,测得
发生上述反应,达到平衡时,测得 的转化率与
的转化率与 的选择性随温度变化的结果如图所示(
的选择性随温度变化的结果如图所示( 的选择性
的选择性 )。
)。
②T℃时,反应
 的平衡常数为
的平衡常数为Ⅱ.CO也可用于制备乙醇:
 ,该反应也存在副反应:
,该反应也存在副反应: 。
。(3)一定温度下,若向2L恒容密闭容器中通入2molCO(g)和
 ,测得部分反应物与生成物的物质的量与时间的关系如图所示:
,测得部分反应物与生成物的物质的量与时间的关系如图所示:

 ;反应从开始到平衡,
;反应从开始到平衡, 的平均反应速率为
的平均反应速率为 。
。 的平衡转化率为
的平衡转化率为②不同的分子筛膜可选择性分离不同分子,若采用能分离水蒸气的分子筛,则对乙醇的选择性产生的影响是
您最近一年使用:0次
2024-01-10更新
|
75次组卷
|
2卷引用:河南省周口市项城市2023-2024学年上学期高三1月阶段测试理综试题
名校
4 . 某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g) cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
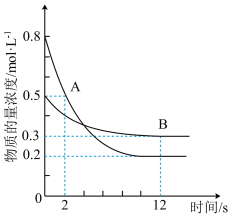
 cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
| A.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1 |
| B.12 s后,A的消耗速率等于B的生成速率 |
| C.化学计量数之比b:c=1:4 |
| D.12 s内,A和B反应放出的热量为0.4Q kJ |
您最近一年使用:0次
2024-01-08更新
|
173次组卷
|
3卷引用:河南省许昌市建安区第一高级中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 工业上常用CO和 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与 的关系如图所示。
的关系如图所示。
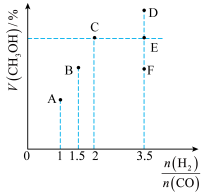
(1)当起始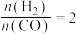 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
___________ 。
(2)B点的平衡常数为_______ (计算结果保留两位小数)。
(3)当起始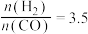 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的___________ 点(填“D”“E”或“F”)。
(4)由下图可知:
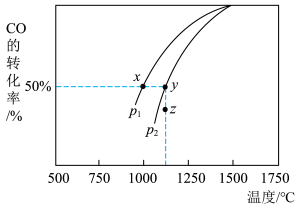
①该反应的
______ 0(填“>”“<”或“=”,下同)。
②相同起始量达到x、y时,容器内气体密度
_______  。
。
③当压强为 时,在z点:
时,在z点:
_______  。
。
 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与 的关系如图所示。
的关系如图所示。
(1)当起始
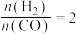 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
(2)B点的平衡常数为
(3)当起始
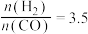 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的(4)由下图可知:

①该反应的

②相同起始量达到x、y时,容器内气体密度
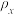
 。
。③当压强为
 时,在z点:
时,在z点:
 。
。
您最近一年使用:0次
名校
6 . 利用反应: 可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入
可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入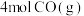 和
和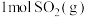 发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
 可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入
可实现从燃煤烟气中回收硫。在恒温恒容条件下,向两个体积均为VL的密闭容器中各充入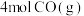 和
和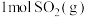 发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
发生该反应,在不同温度下两个反应体系的总压强随时间的变化如图所示。
A.容器Ⅰ中CO的体积分数: |
B.容器Ⅱ中 的平衡转化率是80% 的平衡转化率是80% |
C.平衡常数: |
D. 内用 内用 表示容器I中的平均反应速率为 表示容器I中的平均反应速率为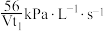 |
您最近一年使用:0次
2023-12-24更新
|
161次组卷
|
4卷引用:河南省濮阳市部分学校2023-2024学年高二上学期12月月考化学试题
名校
7 . 在工业生产中,常常在200℃~450℃的温度范围内,将氨气作为脱硝剂喷入高温烟气脱硝装置中,在催化剂的作用下将烟气中NOx分解成为N2和H2O,脱硝效率可以达到90%以上。请回答下列问题:
(1)在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应: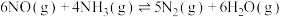
①不能说明该反应已达到平衡状态的是_______ (填标号)。
a.反应速率 b.1 mol N-H键断裂的同时生成1 mol O-H键
b.1 mol N-H键断裂的同时生成1 mol O-H键
c.容器内压强不再随时间而发生变化 d.容器内混合气体平均相对分子质量不再变化
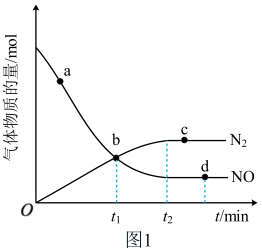
②某次实验中测得容器内NO及N2的物质的量随时间的变化如图1所示,图中b点对应的反应速率关系是
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)一定温度下,在2 L恒容密闭容器内发生反应 ,
,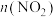 随时间的变化如表:
随时间的变化如表:
①根据表中数据可以看出,随着反应进行,反应速率逐渐减小,其原因是_______ 。
②该温度下,反应 的平衡常数
的平衡常数
_______  。
。
(3)对于反应 ,用平衡时各组分压强关系表达的平衡常数为
,用平衡时各组分压强关系表达的平衡常数为 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系: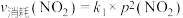 ,
,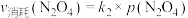 。其中
。其中 、
、 是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是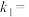
_______ 。在图中标出的点中,指出能表示反应达到平衡态的点_______ ,并请说明理由:_______ 。

(1)在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:
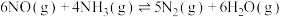
①不能说明该反应已达到平衡状态的是
a.反应速率
 b.1 mol N-H键断裂的同时生成1 mol O-H键
b.1 mol N-H键断裂的同时生成1 mol O-H键c.容器内压强不再随时间而发生变化 d.容器内混合气体平均相对分子质量不再变化
②某次实验中测得容器内NO及N2的物质的量随时间的变化如图1所示,图中b点对应的反应速率关系是

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)一定温度下,在2 L恒容密闭容器内发生反应
 ,
,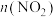 随时间的变化如表:
随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
②该温度下,反应
 的平衡常数
的平衡常数
 。
。(3)对于反应
 ,用平衡时各组分压强关系表达的平衡常数为
,用平衡时各组分压强关系表达的平衡常数为 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系: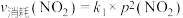 ,
,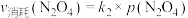 。其中
。其中 、
、 是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是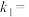

您最近一年使用:0次
2023-12-20更新
|
225次组卷
|
2卷引用:河南省南阳市第一中学校2023-2024学年高二上学期第三次月考化学试题
名校
8 . 甲硫醇( )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:
Ⅰ.
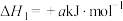
Ⅱ.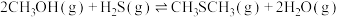
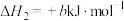
回答下列问题:
(1)计算反应 的ΔH=
的ΔH=___________  。
。
(2) 时,向恒容密闭容器中充入一定量
时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是
发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量 和
和 ,
, 的平衡转化率将
的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C. 的体积分数不再发生变化 D.
的体积分数不再发生变化 D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
(3) 时,按物质的量之比为1︰2向压强为
时,按物质的量之比为1︰2向压强为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。
①计算 的选择性为
的选择性为___________ ( 的选择性
的选择性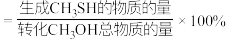 )。
)。
②反应Ⅰ的平衡常数
___________ ( 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。
(4)在 、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。 分压表示的反应速率为
分压表示的反应速率为___________ Mpa/min。
②结合催化机理分析,当温度高于370℃时, 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为___________ 。
③从化学键的角度描述ⅲ→ⅰ脱水的过程:___________ 。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:Ⅰ.

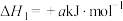
Ⅱ.
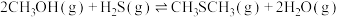
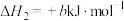
回答下列问题:
(1)计算反应
 的ΔH=
的ΔH= 。
。(2)
 时,向恒容密闭容器中充入一定量
时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是
发生反应,下列事实能说明反应达到平衡状态的是 和
和 ,
, 的平衡转化率将
的平衡转化率将A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.
 的体积分数不再发生变化 D.
的体积分数不再发生变化 D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化(3)
 时,按物质的量之比为1︰2向压强为
时,按物质的量之比为1︰2向压强为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性
的选择性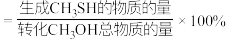 )。
)。②反应Ⅰ的平衡常数

 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。(4)在
 、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。

 分压表示的反应速率为
分压表示的反应速率为②结合催化机理分析,当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从化学键的角度描述ⅲ→ⅰ脱水的过程:
您最近一年使用:0次
2023-12-16更新
|
236次组卷
|
3卷引用:河南省青铜鸣大联考2023-2024学年高三上学期12月月考化学试题
9 . 在3个容积均为 的密闭容器中分别放入
的密闭容器中分别放入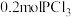 和
和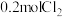 ,在不同条件下发生反应
,在不同条件下发生反应 。各容器内气体总压强随时间的变化如图所示。下列说法错误的是
。各容器内气体总压强随时间的变化如图所示。下列说法错误的是

 的密闭容器中分别放入
的密闭容器中分别放入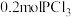 和
和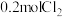 ,在不同条件下发生反应
,在不同条件下发生反应 。各容器内气体总压强随时间的变化如图所示。下列说法错误的是
。各容器内气体总压强随时间的变化如图所示。下列说法错误的是
A.实验a从反应开始至 的平均速率 的平均速率 |
| B.与实验a相比,实验b使用了催化剂,实验c是在较高温度下进行的 |
C.实验c中反应的平衡常数为 |
D.三组实验中反应的平衡转化率: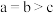 |
您最近一年使用:0次
名校
10 . 在恒温恒容条件下,发生反应: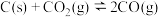 ,测得
,测得 与时间关系如图。下列叙述错误的是
与时间关系如图。下列叙述错误的是

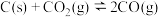 ,测得
,测得 与时间关系如图。下列叙述错误的是
与时间关系如图。下列叙述错误的是
| A.a点逆反应速率小于c点正反应速率 |
B.不同时刻均存在 |
C.b~c段, |
| D.其他条件不变,相对甲曲线,乙曲线可能加入了催化剂 |
您最近一年使用:0次



