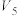和1mol
和1mol  反应生成2mol NO的能量变化示意图如下:
反应生成2mol NO的能量变化示意图如下: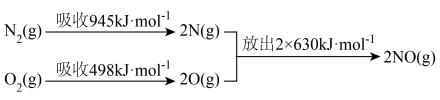
 和2mol
和2mol  充分反应会
充分反应会Ⅱ.高炉炼铁中存在可逆反应:
 。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中气体的浓度与时间的关系如图所示。
气体,反应过程中气体的浓度与时间的关系如图所示。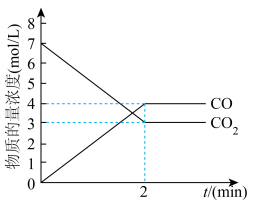
(3)0~2min时间段内,

 。反应达最大限度时,体系内混合气体的平均相对分子质量约为
。反应达最大限度时,体系内混合气体的平均相对分子质量约为(4)下列能判断反应达到平衡状态的是
a.
 b.
b.
c.容器内气体总压强不再变化 d.混合气体的密度不再发生改变
Ⅲ.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间。
混合溶液 | A | B | C | D | E | F |
4 | 30 | 30 |
| 30 |
| 30 |
饱和 | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
|
|
| 17.5 |
| 10 | 0 |
(5)①完成此实验设计,其中:

②该同学最后得出的结论为:当加入少量
 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:
溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因: ,开始时加入1mol
,开始时加入1mol  和3mol
和3mol  ,5min时测得氢气的浓度为0.9
,5min时测得氢气的浓度为0.9 。下列说法错误的是
。下列说法错误的是A.前5min的平均反应速率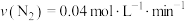 |
B.5min时, 的浓度为0.4 的浓度为0.4 |
| C.5min时的压强与起始时的压强之比为5∶4 |
D.当消耗 和 和 的速率之比为3∶1时,不能说明反应达到化学平衡状态 的速率之比为3∶1时,不能说明反应达到化学平衡状态 |
I.某汽车安全气囊的气体发生剂主要含有叠氮化钠(NaN3)、三氧化二铁(Fe2O3)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,是
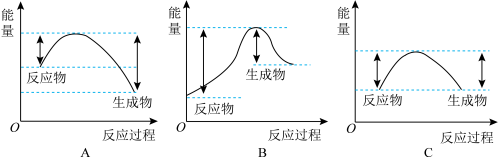
(2)汽车受到猛烈碰撞时,点火器点火引发NaN3迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
Ⅱ.CH4、CH3OH既是重要的化工原料,又是重要的能源物质。
(3)将2.0 mol CH4和4.0 mol H2O(g)通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为(4)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)
 CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的H2O(g) e.加入合适的催化剂
(5)用CH4设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH=K2CO3+3H2O。
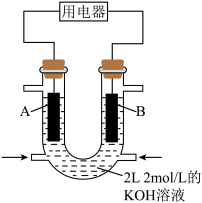
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
| 实验 序号 | 金属质 量/g | 金属 状态 | 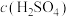 / /(  ) ) |  /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| ⅰ | 1.12 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| ⅱ | 1.12 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| ⅲ | 1.12 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| ⅳ | 1.12 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| ⅴ | 1.12 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)反应的离子方程式为
(2)500 s内反应ⅰ中化学反应速率
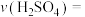
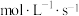 ,生成
,生成 的体积为
的体积为(3)由实验ⅰ、ⅲ可得出的结论是
(4)该实验还能够说明影响反应速率的因素有
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
(6)实验中使用的铁丝为铁、碳合金,将铁丝一端浸入稀硫酸中可以形成原电池,其中铁为
 移动方向为
移动方向为(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥
 与盐酸的反应
与盐酸的反应(2)反应
 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加
 的量
的量②将容器的体积缩小一半
③保持体积不变,充入
 使体系压强增大
使体系压强增大④保持压强不变,充入
 使容器体积变大
使容器体积变大Ⅱ.在体积为
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,测得
,测得 和
和 的浓度随时间变化如图:
的浓度随时间变化如图:
(3)从3min到9min,v(CO2)=
Ⅲ.某研究小组在实验室用硫化碱法制备
 ,实验装置如图:
,实验装置如图: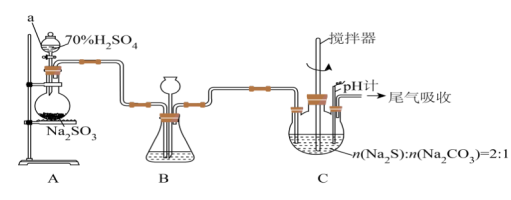
(4)装置
 的作用是
的作用是(5)配制
 溶液时,常加入少量
溶液时,常加入少量 的逸出。
的逸出。(6)为了提高
 的吸收效率,在不改变装置
的吸收效率,在不改变装置 中的溶液浓度、体积的条件下,还可采取的合理措施是
中的溶液浓度、体积的条件下,还可采取的合理措施是a.适当加快搅拌速率 b.加快
 的流速 c.增大
的流速 c.增大 的接触面积
的接触面积
(1)工业合成氨的反应
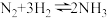 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂 相应化学键需要的能量如下。若反应生成
相应化学键需要的能量如下。若反应生成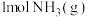 ,可
,可 。
。| 化学键 |  |  |  |
| 能量 | 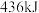 | 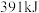 |  |
(2)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应。若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为
(3)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,在恒容密闭容中充入4molCO和4molNO发生2CO(g)+2NO(g)⇌N2(g)+2CO2(g)反应。为提高此反应的速率,下列措施可行的是_____(填字母)。
| A.充入氦气 | B.降低温度 | C.使用适合催化剂 | D.移出CO2 |
(4)汽车尾气中含有的
 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 含量,其工作原理如图所示:
含量,其工作原理如图所示: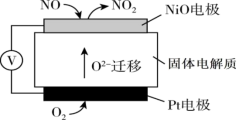
 电极为
电极为 电极上发生的电极反应式为
电极上发生的电极反应式为Ⅰ.海带提碘(海带中碘元素以I-形式存在)
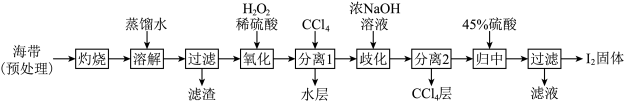
(1)“氧化”过程涉及到的离子方程式是
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为

(4)Bodensteins研究了反应:
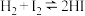 。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:| 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 |
| 1molH2(g)、1molI2(g) | n(H2)mol | 1 | 0.5 | 0.32 | 0.24 | 0.20 |
Ⅲ.生命延续-心脏起搏器中的Li-I2电池
(5)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为
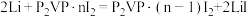 ,其工作原理如图所示:
,其工作原理如图所示: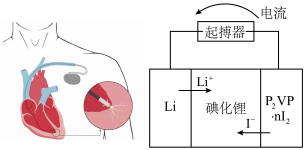
①正极发生的电极反应式为
②放电时,转移0.6×6.02×1023个电子,负极质量减少
Ⅰ.建筑领域的基石材料-硅酸盐
(1)烧制普通玻璃的原料是
(2)实验室不用带玻璃塞的试剂瓶盛装氢氧化钠溶液,写出相关原理反应的离子方程式:
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐,可以将其使用氧化物形式表示,例如Na2SiO3,其氧化物形式为Na2O·SiO2。某种黏土的主要成分为Na[AlSi3O8],将其表示为氧化物的形式为aNa2O·bAl2O3·cSiO2,则a:b:c=
Ⅱ.现代信息的明星材料-硅
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

(5)为提高流化床反应器中的反应速率,可以采取的操作有:
(6)还原炉中发生的化学反应方程式为
(7)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(8)已知反应
 ,一定温度下,向2L恒容密闭容器中充入一定量的
,一定温度下,向2L恒容密闭容器中充入一定量的 、
、 和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为
和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为9 . “碳一化学”是指以碳单质或分子中含一个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。回答下列问题:
(1)我国用铜基催化剂,由CO2加氢制甲醇已工业化,部分反应历程如图所示(带*微粒为催化剂表面的吸附物种,氢原子没有全部标出),由CO2*→CH2O*+OH*过程的焓变△H=△H1+△H2+

(2)
 催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:
催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:主反应:
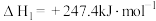
副反应:
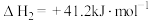
一定温度下,向某2L恒容密闭容器中充入2molCO2和1molCH4,使起始压强为 ,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
①平衡时的总压强为 的代数式表示)。
的代数式表示)。
②在0~30s内,用CO2表示的平均反应速率
 。
。
③该温度下,副反应的压强平衡常数
(3)一定条件下,水气变换反应:
 的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):
的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):i.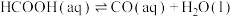
 (快反应);
(快反应);
ⅱ.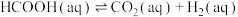
 (慢反应)。
(慢反应)。
研究发现,H+仅对反应i有催化加速作用,反应i速率远大于反应ⅱ,故近似认为反应i建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
①部分物质浓度与反应时间的变化关系如图所示,试推测CO的浓度随反应时间的变化趋势是
A.增大 B.减小 C.先增大后减小 D.先减小后增大

②t1min后,c(HCOOH)/c(CO)的值

(1)该反应的化学方程式为
(2)反应开始至2min,气体Y的平均反应速率是
(3)该条件下,化学平衡常数K=
(4)若升高温度,化学平衡常数K值减小,则上述反应的正反应是
(5)若上述反应在2min后的,
 内反应速率与反应时间关系如图所示:
内反应速率与反应时间关系如图所示:
①下列时刻各改变一种不同的外界条件分别是:


②X的转化率最高的时间段
A.
 B.
B. C.
C. D.
D.

 溶液/mL
溶液/mL

 /mL
/mL