名校
1 . 回答下列问题:
(一).KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目_______ 。
(2)请将上述反应改写成离子方程式_______ 。
(3)浓盐酸在反应中体现出来的性质有_______ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为_______ g。
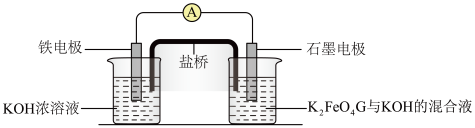
(二).高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是_______ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②每生成1mol FeO 转移
转移_______ 个电子。
(一).KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为
(二).高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO
 转移
转移
您最近一年使用:0次
2 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
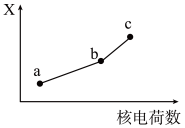
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:四川省眉山北外附属东坡外国语学校2023-2024学年高一下学期开学化学试题
名校
解题方法
3 . Ⅰ.实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:

仪器a的名称是___________ ,装置乙的作用是___________ ,下列说法正确的是:___________ (填序号)。
A.KMnO4溶液用于尾气处理
B.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
C.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
D.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
Ⅱ.某同学为探究NaHSO3溶液与Cu2+的反应,查阅资料设计如下实验:
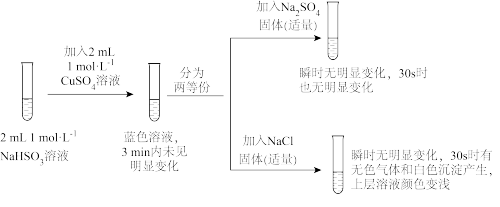
已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
[Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色。工业上将Na2S和Na2CO3以2:1的物质的量比配成溶液,然后通入该无色气体,Na2S、Na2CO3完全反应,得到硫代硫酸钠(Na2S2O3)和另一种无色无味的气体,该过程中发生反应的化学方程式是___________ 。
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
①假设1不成立的原因是___________ 。
②若假设2合理,请将假设2补充完整:___________ ,其中生成的白色沉淀是___________ (填化学式)。
(3)通过分析实验可知,Cl—增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:___________ (写两点即可)。
(4)将实验后的溶液静置24小时或加热后,得到红色沉淀,洗涤干燥后利用已知信息设计实验,证明红色沉淀中含有Cu+:___________ 。

仪器a的名称是
A.KMnO4溶液用于尾气处理
B.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
C.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
D.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
Ⅱ.某同学为探究NaHSO3溶液与Cu2+的反应,查阅资料设计如下实验:

已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
[Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色。工业上将Na2S和Na2CO3以2:1的物质的量比配成溶液,然后通入该无色气体,Na2S、Na2CO3完全反应,得到硫代硫酸钠(Na2S2O3)和另一种无色无味的气体,该过程中发生反应的化学方程式是
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
| 假设1 | Cu2+水解使溶液中c(H+)增大 |
| 假设2 | Cl—存在时,HSO 将Cu2+还原为Cu+,___________ 将Cu2+还原为Cu+,___________ |
②若假设2合理,请将假设2补充完整:
(3)通过分析实验可知,Cl—增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:
| 编号 | 实验1 | 实验2 |
| 实验 |  | 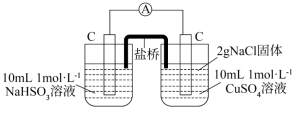 |
| 现象 | 电流表指针发生微小偏转 | 电流表指针发生明显偏转,___________ |
您最近一年使用:0次
4 . 高铁酸钾(K2FeO4)是高效消毒剂,也是制作大功率电池的重要材料。某实验小组欲制备K2FeO4并探究其性质。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)
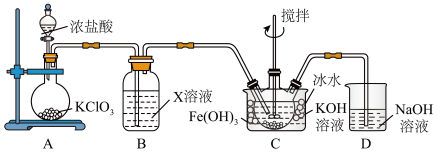
(1)A中发生反应的化学方程式是___________ 。
(2)下列试剂中,装置B的X溶液可以选用的是___________ 。
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是___________ ;若要从反应后的装置C中尽可能得到更多的K2FeO4固体,可以采取的一种措施是___________ 。
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有离子是___________ ,但该离子的来源不能判断一定是K2FeO4与Cl-反应的产物,还可能是反应___________ (用离子方程式表示)的产物。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是___________ 。
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为___________ ;该电池放电时,正极电极反应式为___________ 。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)

(1)A中发生反应的化学方程式是
(2)下列试剂中,装置B的X溶液可以选用的是
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案II | 用KOH溶液洗净C中所得固体,再用一定浓度的KOH溶液将K2FeO,溶出,得到紫色溶液b,取少量b,滴加盐酸.有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为

您最近一年使用:0次
2021-04-17更新
|
908次组卷
|
4卷引用:四川省攀枝花市2021届高三第一次统一考试理科综合化学试题
四川省攀枝花市2021届高三第一次统一考试理科综合化学试题(已下线)第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测2021年北京高考化学试题变式题11-19(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2023年高考化学一轮复习考点微专题
名校
解题方法
5 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.电子跃迁到激发态过程中释放能量产生紫色光—钾盐可用作紫色烟花的原料 |
| B.高铁酸钾(K2FeO4)具有强氧化性—可用作饮用水消毒剂 |
| C.SO2具有较强的还原性—可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| D.Ca(OH)2具有碱性—理科突击班化学社团用熟石灰处理实验后的酸性废水 |
您最近一年使用:0次
2023-08-21更新
|
506次组卷
|
2卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
名校
解题方法
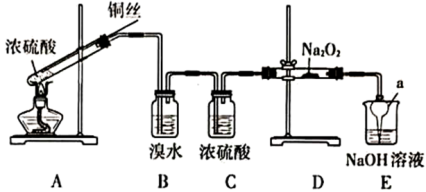
6 . 为研究含硫化合物的性质,某兴趣小组在老师的指导下设计了如下实验。
回答以下问题:
(1)A装置试管中主要反应的化学方程式是___________ 。反应中,浓硫酸表现出的性质是___________ (填正确选项的字母)。
A.酸性 B.氧化性 C.脱水性 D.吸水性
(2)仪器a的名称是___________ ,在本实验中的作用是___________ 。
(3)B中溴水出现的现象是___________ ,说明 具有的性质是
具有的性质是___________ 。
(4)D中 与
与 反应生成
反应生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(5)同学们发现,A装置试管中铜和硫酸均有剩余时反应却自动停止了,由此推测反应与硫酸的浓度有关。同学们通过查阅资料知, 和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
①在盛有过量铜粉的试管中加入 ,
, 浓硫酸进行反应。
浓硫酸进行反应。
②反应自动停止时,收集到 ,测得其他生成物中硫元素的质量共
,测得其他生成物中硫元素的质量共 ,由此可计算出硫酸能与铜反应的最低浓度是
,由此可计算出硫酸能与铜反应的最低浓度是___________  (忽略反应前后溶液体积的变化,计算结果保留一位小数)。
(忽略反应前后溶液体积的变化,计算结果保留一位小数)。

回答以下问题:
(1)A装置试管中主要反应的化学方程式是
A.酸性 B.氧化性 C.脱水性 D.吸水性
(2)仪器a的名称是
(3)B中溴水出现的现象是
 具有的性质是
具有的性质是(4)D中
 与
与 反应生成
反应生成 ,反应的化学方程式是
,反应的化学方程式是(5)同学们发现,A装置试管中铜和硫酸均有剩余时反应却自动停止了,由此推测反应与硫酸的浓度有关。同学们通过查阅资料知,
 和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。①在盛有过量铜粉的试管中加入
 ,
, 浓硫酸进行反应。
浓硫酸进行反应。②反应自动停止时,收集到
 ,测得其他生成物中硫元素的质量共
,测得其他生成物中硫元素的质量共 ,由此可计算出硫酸能与铜反应的最低浓度是
,由此可计算出硫酸能与铜反应的最低浓度是 (忽略反应前后溶液体积的变化,计算结果保留一位小数)。
(忽略反应前后溶液体积的变化,计算结果保留一位小数)。
您最近一年使用:0次
2021-01-07更新
|
441次组卷
|
4卷引用:四川省南充高级中学2020-2021学年高一下学期3月阶段性检测化学试题
四川省南充高级中学2020-2021学年高一下学期3月阶段性检测化学试题广西桂林市2019-2020学年高一上学期期末质量检测化学试题安徽省淮北市树人高级中学2020-2021学年高一上学期期末考试化学试题(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
名校
7 . 木炭与浓硫酸在加热条件下可发生化学反应,为检验反应的产物,某学生设计了如下图所示的实验,请回答下列问题:___________________ (填装置序号甲、乙等,每个装置仅限使用一次);
(2)甲装置中发生反应的化学方程式为_______________________ ,其中木炭被_________ (填“氧化”或“还原”),浓硫酸体现____________ (填“氧化性”或“还原性”或“酸性”);
(3)两次使用品红溶液的作用分别是________________ ,___________ (按连接先后顺序作答);
(4)丁装置中应该盛装的试剂是酸性_____________ ,写出该反应的离子方程式_______________ ;
(5)丙装置中出现的现象是________________ ,该装置的作用是______________ ;
(6)己装置中的现象是___________ ,能否将己的位置调换到丙的后面?______________ ,原因是_______________________ ;

(2)甲装置中发生反应的化学方程式为
(3)两次使用品红溶液的作用分别是
(4)丁装置中应该盛装的试剂是酸性
(5)丙装置中出现的现象是
(6)己装置中的现象是
您最近一年使用:0次
2024-04-30更新
|
120次组卷
|
2卷引用:四川省成都市安宁河联盟2023-2024学年高一下学期期中联考化学试题
2019·广东深圳·一模
名校
解题方法
8 . 铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠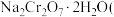 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:
查阅资料得知:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式
为原料,利用铝热反应制取金属铬的化学方程式_______________ 。
(2)酸化滤液D时,不选用盐酸的原因是_____________ 。
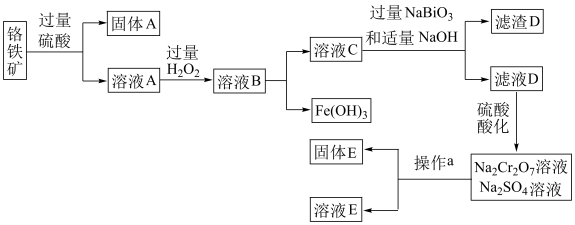
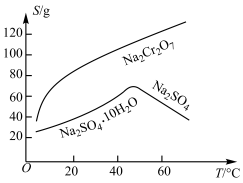
(3)固体E的主要成分是 ,根据如图分析操作a为
,根据如图分析操作a为________________ 、____________ 、洗涤、干燥。
(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
。

① 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________  用离子方程式表示
用离子方程式表示 ;
;
②下列溶液中可以代替上述流程中 溶液最佳的是
溶液最佳的是___________ (填选项序号);
A. 溶液 B.浓
溶液 B.浓 C.酸性
C.酸性 溶液 D.
溶液 D.  溶液
溶液
③上述流程中,每消耗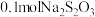 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_____________ 。
(5)某厂废水中含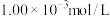 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 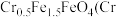 的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、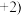 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为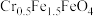 。理论上需要加入
。理论上需要加入________  。(已知
。(已知 摩尔质量为
摩尔质量为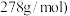
 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠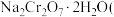 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:

查阅资料得知:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式
为原料,利用铝热反应制取金属铬的化学方程式(2)酸化滤液D时,不选用盐酸的原因是
(3)固体E的主要成分是
 ,根据如图分析操作a为
,根据如图分析操作a为(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
 。
。
①
 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 用离子方程式表示
用离子方程式表示 ;
;②下列溶液中可以代替上述流程中
 溶液最佳的是
溶液最佳的是A.
 溶液 B.浓
溶液 B.浓 C.酸性
C.酸性 溶液 D.
溶液 D.  溶液
溶液③上述流程中,每消耗
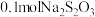 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(5)某厂废水中含
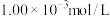 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 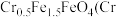 的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、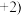 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为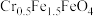 。理论上需要加入
。理论上需要加入 。(已知
。(已知 摩尔质量为
摩尔质量为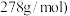
您最近一年使用:0次
2020-02-04更新
|
302次组卷
|
3卷引用:四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题
四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)广东省深圳中学2019届高三5月适应性考试理综化学试题2020届高考化学二轮复习大题精准训练 —— 制备类无机工艺流程题
解题方法
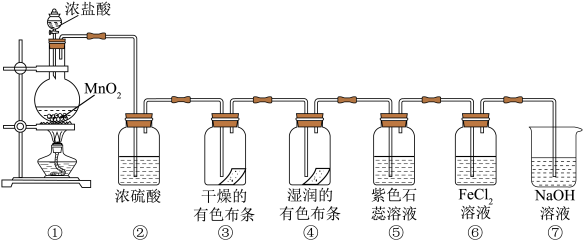
9 . 某同学用下列各装置设计一个实验,验证氯气的性质。
请回答:
(1)盛浓盐酸的仪器名称为___________ 。
(2)①中的化学方程式为___________ ;浓盐酸在反应中显示出来的性质是___________ 。(用字母填空)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②中浓硫酸的作用是___________ 。
(3)③中的实验现象是___________ ;④中的实验现象是___________ ;上述实验现象说明起漂白作用的是___________ (填分子式)。
(4)⑤中的现象是___________
(5)⑥中发生反应的离子方程式是___________
(6)⑦中NaOH溶液的作用是___________ ,试写出反应的离子方程式:___________ 。

请回答:
(1)盛浓盐酸的仪器名称为
(2)①中的化学方程式为
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②中浓硫酸的作用是
(3)③中的实验现象是
(4)⑤中的现象是
(5)⑥中发生反应的离子方程式是
(6)⑦中NaOH溶液的作用是
您最近一年使用:0次
10 . 一位同学在复习时遇到这样一道习题:某无色溶液中可能含有H+、OH-、Na+、NO ,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。
,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。
(1)未开始实验前,_______ (选填“能”、“不能”)确定溶液的酸碱性;加入铝粉产生H2,说明铝具有_______ (填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO 就不能大量存在。设计实验证实如下:
就不能大量存在。设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是_______ 。
②根据现象ⅱ,推测溶液中产生了NO,将生成NO的离子方程式补充完整:_______ 。
_______Al+_______NO +_______=_______Al3++_______NO↑+_______。
+_______=_______Al3++_______NO↑+_______。
(3)再假设:若OH-大量存在,NO 也可能大量存在。重新设计实验证实如下:
也可能大量存在。重新设计实验证实如下:
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_______ ,该反应的氧化剂为:_______
(5)由上述实验得出:该溶液的溶质为_______ 。
 ,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。
,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。(1)未开始实验前,
(2)该同学分析:若H+大量存在,则NO
 就不能大量存在。设计实验证实如下:
就不能大量存在。设计实验证实如下:| 装置 | 现象 |
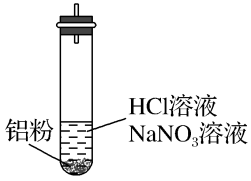 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,将生成NO的离子方程式补充完整:
_______Al+_______NO
 +_______=_______Al3++_______NO↑+_______。
+_______=_______Al3++_______NO↑+_______。(3)再假设:若OH-大量存在,NO
 也可能大量存在。重新设计实验证实如下:
也可能大量存在。重新设计实验证实如下:| 装置 | 现象 |
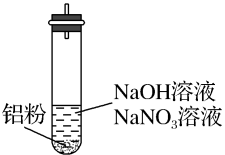 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味,经检验该气体含NH3 |
(5)由上述实验得出:该溶液的溶质为
您最近一年使用:0次
2021-01-06更新
|
537次组卷
|
3卷引用:四川省南充高级中学2020-2021学年高一上学期第二次月考化学试题
四川省南充高级中学2020-2021学年高一上学期第二次月考化学试题(已下线)5.2.3 硝酸 酸雨及其防治-2021-2022学年高一化学课后培优练(人教版2019必修第二册)第二节 金属材料 第1课时 合金



