1 . 铜、硫及其化合物在工业中用途广泛。请回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)硫酰氟 常温常压下为无色气体,固态
常温常压下为无色气体,固态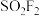 的晶体类型为
的晶体类型为___________ ,其F-S-F键角___________ (填“>”或“<”)硫酰氯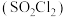 中的
中的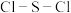 键角。
键角。
(3)硫酸四氨合铜晶体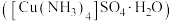 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备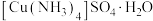 的流程如下:
的流程如下:
①写出过程 发生反应的离子方程式
发生反应的离子方程式___________ 。
②过程c加入 乙醇的作用是
乙醇的作用是___________ 。
③根据 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序___________ 。
(4)硫化铜的立方晶胞结构如图所示,已知 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长=___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)硫酰氟
 常温常压下为无色气体,固态
常温常压下为无色气体,固态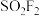 的晶体类型为
的晶体类型为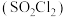 中的
中的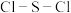 键角。
键角。(3)硫酸四氨合铜晶体
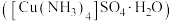 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备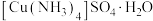 的流程如下:
的流程如下: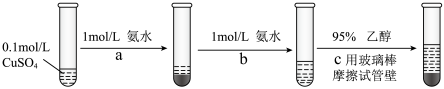
①写出过程
 发生反应的离子方程式
发生反应的离子方程式②过程c加入
 乙醇的作用是
乙醇的作用是③根据
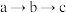 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序(4)硫化铜的立方晶胞结构如图所示,已知
 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长= (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
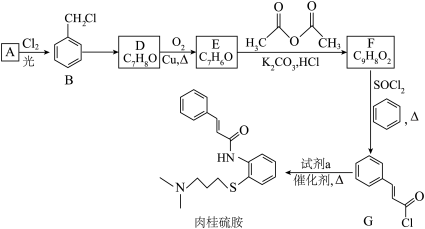
2 . 药物“肉桂硫胺”的部分合成路线如图所示(部分反应条件已略去):___________ ,A→B的化学方程式是___________ 。
(2)有机物D中所含的官能团的名称是___________ 。
(3)B→D的化学反应类型是___________ 。
(4)下列关于A的说法正确的是___________ (填字母)。
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是___________ 。
(6)有机物F为反式结构,其结构简式是___________ 。
已知:
(2)有机物D中所含的官能团的名称是
(3)B→D的化学反应类型是
(4)下列关于A的说法正确的是
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是
(6)有机物F为反式结构,其结构简式是
您最近一年使用:0次
真题
3 . 将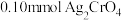 配制成
配制成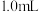 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
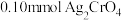 配制成
配制成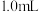 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
A.交点a处: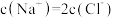 |
B.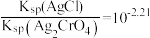 |
C.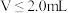 时, 时,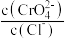 不变 不变 |
D.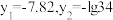 |
您最近一年使用:0次
4 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第___________ 周期第___________ 族,Co位于元素周期表___________ 区。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知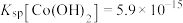 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5)导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
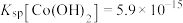 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
名校
解题方法
5 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
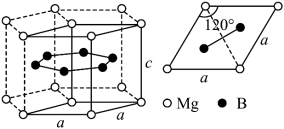
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
您最近一年使用:0次
名校
6 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与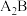 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,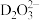 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成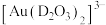 。
。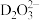 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
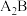 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
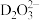 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成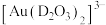 。
。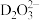 中的配位原子为
中的配位原子为
您最近一年使用:0次
名校
7 . 查阅资料可知:Bi位于周期表的第VA族, 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:
①向稀硫酸酸化的 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。
②继续滴加适量草酸 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。
下列说法正确的是
 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:①向稀硫酸酸化的
 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。②继续滴加适量草酸
 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。下列说法正确的是
| A.Bi的基态原子中只含一个未成对电子 |
B.由操作①现象可知酸性条件下氧化性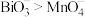 |
C.操作②中每生成标准状况下 ,反应转移1mol电子 ,反应转移1mol电子 |
D.向稀硫酸酸化的 中加入草酸,溶液会变为紫红色 中加入草酸,溶液会变为紫红色 |
您最近一年使用:0次
7日内更新
|
16次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
8 . X、Y、Z、W、E、F、G是原子序数小于36的七种元素,且原子序数依次增大。X元素基态原子的价电子排布式为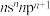 ;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
(1)E元素基态原子的电子排布式为________ 。基态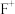 的电子排布式为
的电子排布式为________ 。
(2)Z、W形成的简单离子半径较小的是________ (填离子符号)。
(3)比较X、Y的第一电离能大小并说明理由:________ 。
(4)F元素位于元素周期表的________ 区。
(5)G元素在周期表中的位置是________ ,其可能具有的性质是________ (填字母)。
A.其单质具有较强的导电性 B.其最高价氧化物对应水化物的化学式为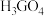
C.其原子半径大于锗 D.其第一电离能小于硒
(6)元素X基态原子能量最高的电子所处原子轨道的形状为________ 形,若氢原子与这些电子所处的轨道采用“头碰头”的方式成键,则所得分子中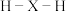 的键角理论上为
的键角理论上为________ 。
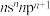 ;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。(1)E元素基态原子的电子排布式为
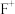 的电子排布式为
的电子排布式为(2)Z、W形成的简单离子半径较小的是
(3)比较X、Y的第一电离能大小并说明理由:
(4)F元素位于元素周期表的
(5)G元素在周期表中的位置是
A.其单质具有较强的导电性 B.其最高价氧化物对应水化物的化学式为
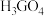
C.其原子半径大于锗 D.其第一电离能小于硒
(6)元素X基态原子能量最高的电子所处原子轨道的形状为
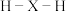 的键角理论上为
的键角理论上为
您最近一年使用:0次
7日内更新
|
24次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
解题方法
9 . 催化氧化乳酸乙酯制备丙酮酸乙酯,一种可能的反应机理如图所示(其中,—Me表示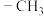 、—Et表示
、—Et表示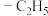 ):
):
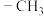 、—Et表示
、—Et表示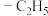 ):
):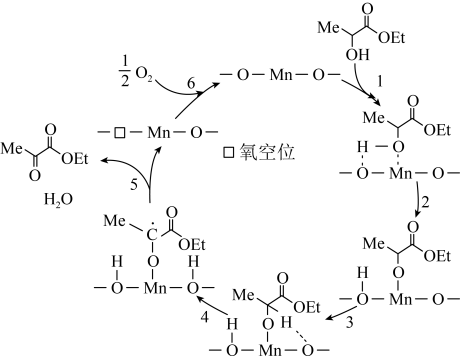
| A.反应过程中,Mn元素的化合价不发生变化 |
B.若不提供 ,则体系中也可产生丙酮酸乙酯 ,则体系中也可产生丙酮酸乙酯 |
C.理论上,消耗 可生成 可生成 丙酮酸乙酯 丙酮酸乙酯 |
D.若提供 ,则产物中含 ,则产物中含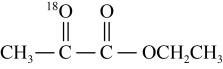 |
您最近一年使用:0次
7日内更新
|
217次组卷
|
3卷引用:湖北省武汉市部分学校2023-2024学年高三下学期五月模拟训练题化学试卷
名校
10 . 4-溴甲基肉桂酸甲酯是合成抗肿瘤药物帕比司他的重要中间体,其结构简式如图。关于该有机物的说法错误的是
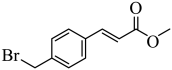
| A.能发生加成反应、氧化反应、聚合反应 |
| B.含有3种官能团 |
| C.其苯环上的二氯代物有四种(不考虑立体异构) |
| D.最多有18个原子共平面 |
您最近一年使用:0次
7日内更新
|
438次组卷
|
2卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学



