名校
1 . 下列物质属于电解质且溶于水为碱性的是
A. | B. | C. | D. |
您最近一年使用:0次
2 . 喹啉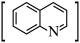 广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
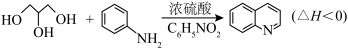
| 物质 | 分子式 | 相对分子质量 | 熔点(℃) | 沸点(℃° |
| 甘油 |  | 92 | 17.8 | 290 |
| 苯胺 | 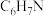 | 93 | -6.2 | 184 |
| 硝基苯 | 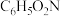 | 123 | 6 | 210 |
| 喹啉 | 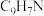 | 129 | -15.6 | 238.1 |
ⅱ.硫酸亚铁作反应的缓和剂。
实验步骤:
①预热:在250 mL三颈烧瓶中,加入2.0 g
 晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。
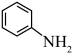
晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。②加料:待自然降温至100℃左右,依次加入4.65 g苯胺,4 g硝基苯和9 mL浓硫酸。
③制备:先用小火加热装置A,当反应液微沸时先立即移去加热装置,保持微沸继续反应,后小火回流2 h。
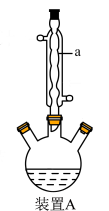
⑤蒸出:将溶液转移至圆底烧瓶,滴加40%NaOH溶液至强碱性,再用水蒸气蒸出。
⑥提纯:将粗品经分离、提纯、干燥后得到产品4.3g。
请回答下列问题:
(1)仪器a的名称是
(2)步骤③中,移去加热装置后若反应液继续沸腾,可采取的方法是
(3)用离子方程式表示步骤④中淀粉-KI试纸变蓝的原因:
(4)已知
 与
与 在酸性条件下反应生成重氮盐,加热煮沸时水解产生
在酸性条件下反应生成重氮盐,加热煮沸时水解产生 和苯酚。
和苯酚。步骤⑤中加入40%NaOH溶液的作用有:①
(5)检验步骤⑤中苯酚是否除尽的实验操作是
(6)计算该实验中喹啉的产率:
您最近一年使用:0次
7日内更新
|
41次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
名校
3 . 以黄铁矿(主要成分是 ,设杂质均不参与反应)为原料来生产硫酸的工艺流程如图。下列说法
,设杂质均不参与反应)为原料来生产硫酸的工艺流程如图。下列说法不正确 的是
 ,设杂质均不参与反应)为原料来生产硫酸的工艺流程如图。下列说法
,设杂质均不参与反应)为原料来生产硫酸的工艺流程如图。下列说法
| A.将黄铁矿粉碎的目的是增大接触面积,加快反应速率 |
B.该生成工艺中每生成 ,有 ,有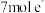 发生转移 发生转移 |
C. 和 和 均是酸性氧化物,溶于水均得到相应的酸 均是酸性氧化物,溶于水均得到相应的酸 |
D.不用水吸收 的原因是 的原因是 与 与 化合时放出大量热,易形成酸雾 化合时放出大量热,易形成酸雾 |
您最近一年使用:0次
名校
4 . 下列化学用语表示正确的是
A.溴的简化电子排布式: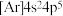 |
B. 的离子结构示意图: 的离子结构示意图: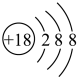 |
C. 分子的空间填充模型: 分子的空间填充模型: |
D.羟基的电子式: |
您最近一年使用:0次
5 . 已知: 在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备
在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备 。
。
Ⅰ.在100mL锥形瓶内加入4.5g研细的 、3g
、3g  和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL 溶液。
溶液。
Ⅲ.在60℃下反应一段时间后,再经过一系列操作,得到 晶体。
晶体。
下列说法不正确的是
 在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备
在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备 。
。Ⅰ.在100mL锥形瓶内加入4.5g研细的
 、3g
、3g  和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL
 溶液。
溶液。Ⅲ.在60℃下反应一段时间后,再经过一系列操作,得到
 晶体。
晶体。下列说法不正确的是
A.步骤Ⅰ中加入 的原因之一是增大 的原因之一是增大 的浓度,以抑制步骤Ⅱ中 的浓度,以抑制步骤Ⅱ中 的电离 的电离 |
B.步骤Ⅱ控制温度在10℃以下的主要原因是防止 和 和 受热分解 受热分解 |
| C.步骤Ⅲ中一系列的操作包括蒸发浓缩、降温结晶、过滤、洗涤、干燥 |
D.该反应化学方程式为 |
您最近一年使用:0次
6 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.常温下,1L pH=3的 溶液中含有 溶液中含有 的数目为0.003 的数目为0.003 |
B.2.0g由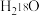 与 与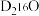 组成的混合物所含中子的数目为 组成的混合物所含中子的数目为 |
C.28.4g  ( (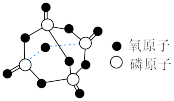 )含 )含 键的数目为1.2 键的数目为1.2 |
D.反应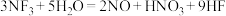 中若有1mol 中若有1mol  参与反应,则理论上转移电子的数目为3.6 参与反应,则理论上转移电子的数目为3.6 |
您最近一年使用:0次
名校
7 . 反应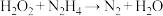 (未配平)可为火箭发射提供动力,下列说法错误的是
(未配平)可为火箭发射提供动力,下列说法错误的是
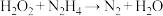 (未配平)可为火箭发射提供动力,下列说法错误的是
(未配平)可为火箭发射提供动力,下列说法错误的是A.17g 溶液中含有氧原子的数目为 溶液中含有氧原子的数目为 |
B.0.1mol 中含有质子的数目为 中含有质子的数目为 |
C.常温常压下,3.2g 中含有共用电子对的数目为0.5 中含有共用电子对的数目为0.5 |
D.标准状况下,生成22.4L 时转移电子的数目为4 时转移电子的数目为4 |
您最近一年使用:0次
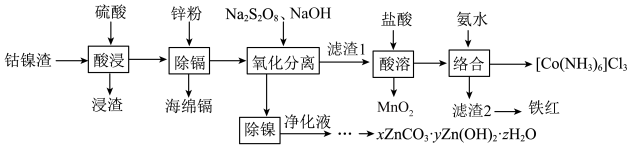
8 . 湿法炼锌的主要工序有焙烧、浸出、净化和电积,浸出后获得大量的含Zn、Co、Ni、Fe、Mn、Cd等金属的钴镍渣,为有效回收钴镍渣中的有价金属,设计如图所示的工艺流程:___________ (填1条即可)。“酸溶”时却不宜采用加热的方法来加快反应速率,其原因是___________ 。
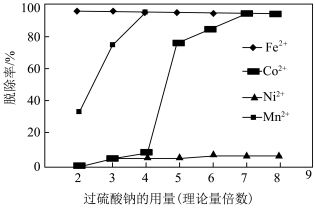
(2)“氧化分离”时,过硫酸钠的用量与溶液中金属离子的脱除率的关系如图所示。___________ (填字母)倍。
a.2~3 b.4~5 c.7~8
(3)滤渣1中主要含MnO2、_______ ,写出生成MnO2的离子方程式:_________ 。
(4)由碱式碳酸锌可制备ZnO,ZnO的晶胞结构如图,则锌的配位数为___________ ;已知晶胞参数为acm,该晶体的密度为___________ g∙cm-3 (列出计算式,阿伏加德罗常数的值为NA)。
(2)“氧化分离”时,过硫酸钠的用量与溶液中金属离子的脱除率的关系如图所示。
①氧化剂Na2S2O8的阴离子结构为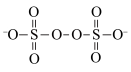 ,其中硫元素化合价为
,其中硫元素化合价为
a.2~3 b.4~5 c.7~8
(3)滤渣1中主要含MnO2、
(4)由碱式碳酸锌可制备ZnO,ZnO的晶胞结构如图,则锌的配位数为
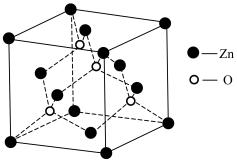
您最近一年使用:0次
解题方法
9 . 碲广泛用于半导体器件、合金、化工原料及铸铁、橡胶、玻璃等工业。工业上利用电解铜的阳极泥(主要成分为 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。
② 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为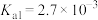 ,
,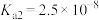 。
。
回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为_______ (写一种即可);流程中多次用到过滤操作,实验室进行过滤时需要用到的玻璃仪器有烧杯、_______ 。
(2)“氧化焙烧”后碲元素转化为 ,写出
,写出 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“水浸”后,“滤液”中溶质的主要成分为_______ (填化学式)。
(4)“酸化”后,碲以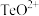 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为_______ 。
(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中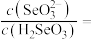
_______ 。
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为_______ ,Cd原子周围等距离且最近的Te原子为_______ 个,测得碲化镉晶体的密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为_______ pm。
 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。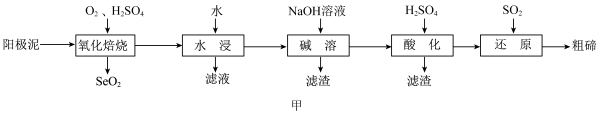
 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。②
 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为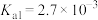 ,
,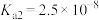 。
。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为
(2)“氧化焙烧”后碲元素转化为
 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(3)“水浸”后,“滤液”中溶质的主要成分为
(4)“酸化”后,碲以
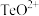 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中
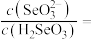
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为
 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为
您最近一年使用:0次
7日内更新
|
32次组卷
|
3卷引用:2024届河南省重点高中高三下学期4月联考模拟预测理综试题-高中化学
10 . 乙炔俗称风煤或电石气,在室温下是一种无色、易燃的气体。乙炔气经净化处理后,在氮气氛中可催化聚合为聚乙炔,下列说法正确的是
A.乙炔分子是既有 键和 键和 键也有极性键和非极性键的极性分子 键也有极性键和非极性键的极性分子 |
B.乙炔分子的电子式: |
C.乙炔分子的空间充填模型: |
| D.相同质量的乙炔和聚乙炔完全燃烧耗氧量不同 |
您最近一年使用:0次



