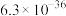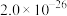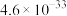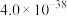1 . 磷酸铁锂前驱体磷酸铁是一种重要的化工原料,被广泛用于汽车电池。用浓硫酸浸取钛铁矿(主要成分为 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:___________ 。
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若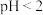 ,会导致
,会导致___________ ;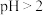 ,会导致
,会导致___________ 。
(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是___________ 。将滤液收集用于溶解步骤,其目的是___________ (答出两条即可)。
(4)在该流程中,以 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为___________ 。
(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为___________ 。 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为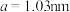 、
、 、
、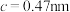 ,
,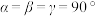 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下: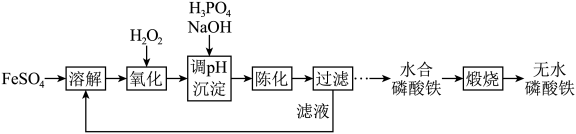
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若
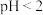 ,会导致
,会导致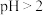 ,会导致
,会导致(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是
(4)在该流程中,以
 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为

 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为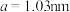 、
、 、
、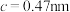 ,
,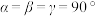 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。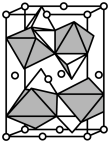
您最近半年使用:0次
昨日更新
|
25次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
名校
解题方法
2 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: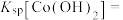
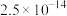 、
、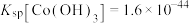 、
、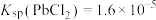 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,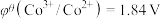 、
、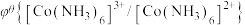
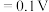 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: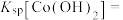
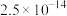 、
、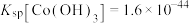 、
、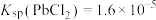 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,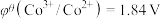 、
、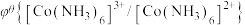
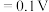 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近半年使用:0次
名校
解题方法
3 . “尚义四台遗址”是中国北方地区考古发现的最早定居村落,时间最久的距今已有10000~10400年,入围“2023年度全国十大考古新发现”终评项目名单。下列关于该发现的说法错误的是
A.可通过对动物骨骼中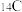 的测定确定遗址时间 的测定确定遗址时间 |
| B.遗址中出土的陶器属于硅酸盐产品 |
| C.遗址中出土的动物骨骼和贝类遗物能保存至今是因为浸泡过福尔马林 |
| D.遗址中出土的打制石器、细石器、磨制石器等的制造过程属于物理变化 |
您最近半年使用:0次
解题方法
4 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□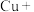 □
□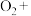 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应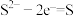 ,
,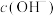 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
| 向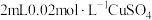 溶液中加入 溶液中加入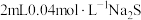 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为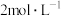 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
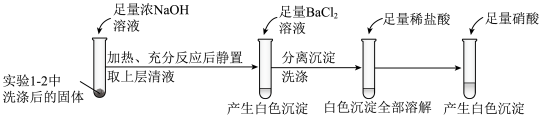
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
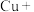 □
□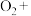 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 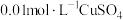 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 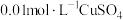 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 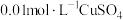 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
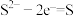 ,
,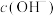 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近半年使用:0次
5 . 一种利用某镍矿资源(主要成分为 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 )提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
)提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
i.25℃时,一些物质的 如下:
如下:
ii.溶液中离子浓度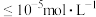 时认为该离子沉淀完全。
时认为该离子沉淀完全。
(1)流程中能加快反应速率的措施有_________ 。
(2)固体A中还有少量酸浸后剩余的NiS,II中反应的离子方程式为_________ 。
(3)III中,生成 转移
转移 ,III中反应的化学方程式为
,III中反应的化学方程式为_________ ;III过滤后得到的固体残渣中含有的物质是_________ 。
(4)IV可以除去溶液D中的 ,由此推测氧化性
,由此推测氧化性
_________  (填“>”或“<”)。
(填“>”或“<”)。
(5)结合离子方程式解释V中加入 的作用:
的作用:_________ 。
(6)为了使 沉淀完全,VI中溶液pH的最小值所属范围为
沉淀完全,VI中溶液pH的最小值所属范围为_________ (填字母)。
a.2~3 b.3~4 c.9~10 d.10~11
(7)VI中, 不宜多加,原因是
不宜多加,原因是_________ 。
 、
、 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 )提取含Ni、Cu、Fe、Mg、Al的物质的流程如下:
)提取含Ni、Cu、Fe、Mg、Al的物质的流程如下: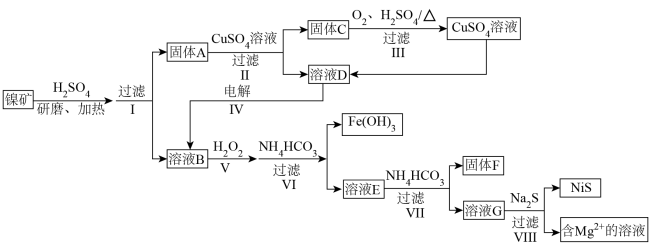
i.25℃时,一些物质的
 如下:
如下:物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
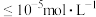 时认为该离子沉淀完全。
时认为该离子沉淀完全。(1)流程中能加快反应速率的措施有
(2)固体A中还有少量酸浸后剩余的NiS,II中反应的离子方程式为
(3)III中,生成
 转移
转移 ,III中反应的化学方程式为
,III中反应的化学方程式为(4)IV可以除去溶液D中的
 ,由此推测氧化性
,由此推测氧化性
 (填“>”或“<”)。
(填“>”或“<”)。(5)结合离子方程式解释V中加入
 的作用:
的作用:(6)为了使
 沉淀完全,VI中溶液pH的最小值所属范围为
沉淀完全,VI中溶液pH的最小值所属范围为a.2~3 b.3~4 c.9~10 d.10~11
(7)VI中,
 不宜多加,原因是
不宜多加,原因是
您最近半年使用:0次
解题方法
6 . 我国科研人员研发的海泥细菌电池不仅可以作为海底仪器的水下电源,还可以促进有机污染物(以 表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
 表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是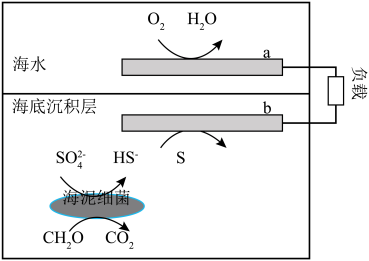
| A.a极为电池负极 |
B.b极的电极反应为 |
C.若b极区生成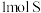 ,则a极区 ,则a极区 增加2mol 增加2mol |
D.外电路通过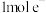 时,至少有 时,至少有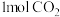 生成 生成 |
您最近半年使用:0次
7 . 在碘水、淀粉、稀 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: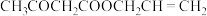
AAAI为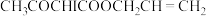
下列说法不正确 的是
 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: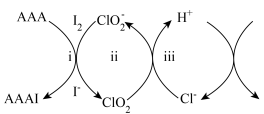
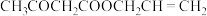
AAAI为
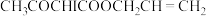
下列说法
| A.i为取代反应 | B.ii的反应为 |
C.iii中,生成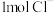 转移 转移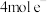 | D.最终溶液呈蓝色 |
您最近半年使用:0次
8 . 近年来,有研究团队提出基于锂元素的电化学过程合成氨的方法,主要流程如下:不正确 的是
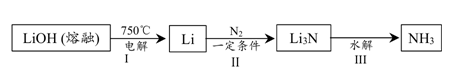
| A.I中,Li在电解池的阳极产生 | B.I中有 、 、 生成 生成 |
C.Ⅱ中, 作氧化剂 作氧化剂 | D.该方法中,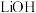 可循环利用 可循环利用 |
您最近半年使用:0次
解题方法
9 . 下列化学用语或图示表达正确的是
A.甲醇的空间填充模型: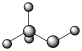 | B. 的离子结构示意图: 的离子结构示意图: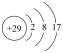 |
C. 杂化轨道示意图: 杂化轨道示意图: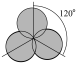 | D.过氧化氢的电子式: |
您最近半年使用:0次
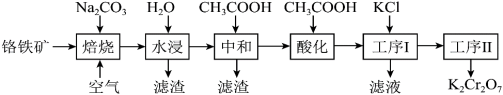
10 . 重铬酸钾(K2Cr2O7)是一种重要的化工原料,可用于制铬矾、火柴、铬颜料,并供鞣革、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,质量分数为67.2%,杂质主要为硅、铁、铝的氧化物]为原料制备重铬酸钾的工艺流程如图所示:
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
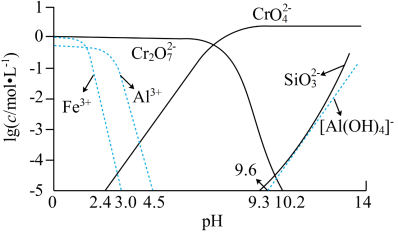
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:______ 。
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:_______ 。
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是_______ (填化学式)。
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:______ 。
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是_______ ,生产过程的产率为______ 。
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为_______ 。(滴定过程中发生的反应为Cr2O +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为
 +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
您最近半年使用:0次