名校
1 . 铁、钴在元素周期表中处于相邻位置,其单质及其化合物在工业生产中有重要用途:
(1)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
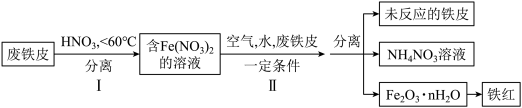
①步骤Ⅰ中的硝酸是三大强酸之一,其电离方程式为_______ ,曾出若温度过高,将导致硝酸分解,硝酸分解的化学方程式为_______ ;
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,硝酸的还原产物为硝酸铵,该反应的化学方程式为_______ ;
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
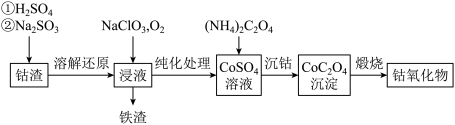
已知:Co(OH)3难溶于水,具有很强的氧化性。Co(OH)3溶解还原反应的离子方程式为_______ ,铁渣中铁元素的化合价为_______ ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量2.41 g,CO2的体积为1.344 L(标准状况),则钴氧化物的化学式为_______ 。
(1)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ中的硝酸是三大强酸之一,其电离方程式为
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,硝酸的还原产物为硝酸铵,该反应的化学方程式为
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

已知:Co(OH)3难溶于水,具有很强的氧化性。Co(OH)3溶解还原反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是


| A.过程①中,生成CuS的反应为H2S+Cu2+ = CuS↓+2H+ |
| B.过程②中,Fe3+作还原剂 |
| C.转化图中化合价不变的元素只有铜和氯 |
| D.回收S的总反应为2H2S+O2 = 2H2O+2S↓ |
您最近一年使用:0次
3 . PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。
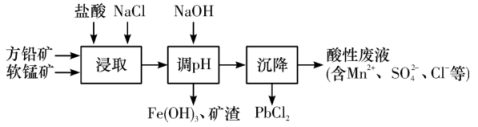
已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0
(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为__ 。
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__ 。
(3)调pH的目的是__ 。
(4)沉降池中获得PbCl2采取的两种措施是__ 。(根据平衡的观点)
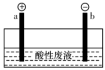
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为__ 。

已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是
(3)调pH的目的是
(4)沉降池中获得PbCl2采取的两种措施是
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为

您最近一年使用:0次
名校
4 . 氧钒(IV)碱式碳酸铵晶体化学式为:(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,实验室以V2O5为原料制备该晶体的流程如图:
V2O5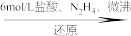 VOCl2溶液
VOCl2溶液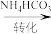 氧钒(IV)碱式碳酸铵晶体
氧钒(IV)碱式碳酸铵晶体
(1)N2H4的电子式是_______ 。若“还原”后其它产物均绿色环保,写出该反应的化学方程式_______  。
。
(2)“转化”可在如图装置中进行。(已知VO2+能被O2氧化)
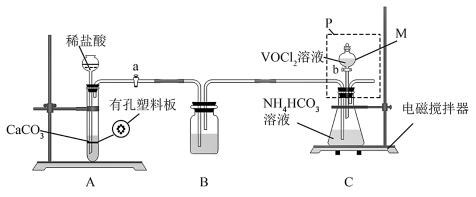
①仪器M的名称是_______ 。使A中制气反应停止的操作是_______ 。
②装置C中将VOCl2转化并得到产品,实验操作顺序为:打开活塞a→_______ →_______ →_______ .(填标号)。
I.取下P(如图),锥形瓶口塞上橡胶塞
II.将锥形瓶置于干燥器中,静置后过滤
III.打开活塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是_______ (填离子符号),用乙醚洗涤的目的是_______ 。
④称量mg产品于锥形瓶中,先将产品中钒元素转化为VO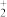 ,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO
,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO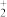 +Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为_______ (以VO2+的量进行计算,列出计算式)。
V2O5
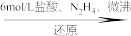 VOCl2溶液
VOCl2溶液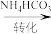 氧钒(IV)碱式碳酸铵晶体
氧钒(IV)碱式碳酸铵晶体(1)N2H4的电子式是
 。
。(2)“转化”可在如图装置中进行。(已知VO2+能被O2氧化)

①仪器M的名称是
②装置C中将VOCl2转化并得到产品,实验操作顺序为:打开活塞a→
I.取下P(如图),锥形瓶口塞上橡胶塞
II.将锥形瓶置于干燥器中,静置后过滤
III.打开活塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是
④称量mg产品于锥形瓶中,先将产品中钒元素转化为VO
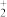 ,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO
,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO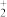 +Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为
您最近一年使用:0次
2021-03-12更新
|
392次组卷
|
2卷引用:湖南省永州市第一中学2021届高三3月联考化学试卷
名校
解题方法
5 . 如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去)

(1)反应①说明SO2具有___________ ,溶液变蓝后又褪色,其中褪色的原因是___________ (用化学方程式表示);
(2)反应②中若得到生成物n(Na2SO3):n(NaHSO3)=1:1时,则此时反应物n(SO2):n(NaOH)=___________ ;
(3)反应⑤的化学方程式为___________ 。

(1)反应①说明SO2具有
(2)反应②中若得到生成物n(Na2SO3):n(NaHSO3)=1:1时,则此时反应物n(SO2):n(NaOH)=
(3)反应⑤的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 稀土元素钪(Sc)广泛应用于航空航天、超导、激光、核能等领域,从钛白水解工业废酸(含Sc3+、TiO2+、Mn2+、H+、SO 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
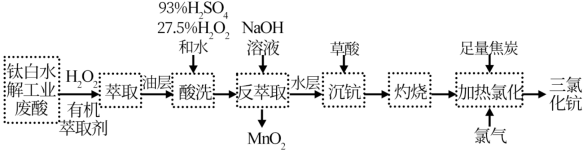
已知:Ag2CrO4为砖红色固体;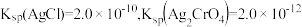 。
。
请回答下列问题:
(1)在钛白水解工业废酸中,加入 是为了使
是为了使 转化为难萃取的
转化为难萃取的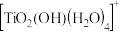 。
。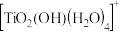 中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比
中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比___________ 。
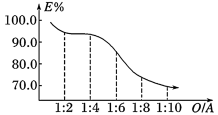
(2)钪的萃取率(E%)与 O/A 值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的 O/A 值为___________ 。
(3)温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15℃,其理由是___________ 。
(4)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式___________ 。
(5)实验室模拟流程中 “灼烧”得到 Sc2O3,用来盛放被灼烧物的仪器为___________ ,写出由Sc2O3制备三氯化钪反应的化学方程式___________ 。
(6)取 ScCl3粗产品(含难溶 Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用 AgNO3标准溶液滴定,当溶液中出现的现象为___________ 时,说明已经达到滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,此时溶液中 的浓度等于
的浓度等于___________ mol·L-1。
 等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
等离子)中提取氧化钪并制备三氯化钪(ScCl3)的一种工艺流程如下:
已知:Ag2CrO4为砖红色固体;
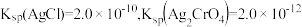 。
。请回答下列问题:
(1)在钛白水解工业废酸中,加入
 是为了使
是为了使 转化为难萃取的
转化为难萃取的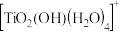 。
。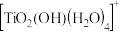 中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比
中Ti的化合价为+4,其中-1 价氧和-2 价氧的物质的量之比(2)钪的萃取率(E%)与 O/A 值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的 O/A 值为

(3)温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(5)实验室模拟流程中 “灼烧”得到 Sc2O3,用来盛放被灼烧物的仪器为
(6)取 ScCl3粗产品(含难溶 Sc2O3杂质)溶于水,配成溶液,采用K2CrO4为指示剂,用 AgNO3标准溶液滴定,当溶液中出现的现象为
 的浓度等于
的浓度等于
您最近一年使用:0次
2021-03-04更新
|
542次组卷
|
4卷引用:湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题
湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题广东省梅州市2021届高三一模化学试卷广东省梅州市2021届高三下学期3月总复习质检化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)
名校
解题方法
7 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

已知电解总反应为:
回答下列问题:
(1)NaClO2中Cl的化合价为_______ 。
(2)工业上常用黄铁矿(FeS2)为原料制备硫酸,配平下面方程式:_____________ 。
_______FeS2+_______O2 _______Fe2O3+_______。
_______Fe2O3+_______。
(3)从物质分类角度来看,NaHSO4是_______ (填字母代号)。
a.酸 b.酸式盐 c.电解质 d.非电解质 e.离子化合物 f.共价化合物
(4)写出“反应”步骤中生成ClO2的化学方程式_______ 。
(5)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为_______ 、_______ 。
(6)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂(ClO2)与还原剂(H2O2)的物质的量之比为_______ 。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(NaClO2、Cl2的还原产物都是Cl-)。NaClO2的有效氯含量为_______ (计算结果保留两位小数)。

已知电解总反应为:

回答下列问题:
(1)NaClO2中Cl的化合价为
(2)工业上常用黄铁矿(FeS2)为原料制备硫酸,配平下面方程式:
_______FeS2+_______O2
 _______Fe2O3+_______。
_______Fe2O3+_______。(3)从物质分类角度来看,NaHSO4是
a.酸 b.酸式盐 c.电解质 d.非电解质 e.离子化合物 f.共价化合物
(4)写出“反应”步骤中生成ClO2的化学方程式
(5)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为
(6)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂(ClO2)与还原剂(H2O2)的物质的量之比为
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(NaClO2、Cl2的还原产物都是Cl-)。NaClO2的有效氯含量为
您最近一年使用:0次
2021-03-04更新
|
490次组卷
|
2卷引用:湖南省长沙市一中2020-2021学年高一上学期期末考试化学试题
名校
8 . 根据所学知识,回答下列问题:
(1)反应4HCl(浓) 中,氧化剂是
中,氧化剂是_______ ,还原产物是_______ ;MnO2与被氧化的HCl的物质的量之比是_______ 。
(2)实验室用Na3CO3固体配制500 mL 1 mol/L的Na3CO3溶液。配制时必需的玻璃仪器有:烧杯、量筒、玻璃棒、_______ 、_______ 。定容时仰视刻度线会导致浓度_______ (填“偏高”“偏低”或“无影响”,下同),定容摇匀后发现液面低于刻度线再加水至刻度线,浓度会_______ 。
(3)在标准状况下,CO和CO2混合气体共33.6 L,质量为62 g,则两种气体的物质的量之和为_______ mol,Co与CO2物质的量之比为_______ 。
(4)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,实验室可用NaClO溶液与NH3反应制备联氨,反应的化学方程式为_______ 。已知
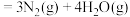 ,分析联氨和N2O4可作为火箭推进剂的主要原因为
,分析联氨和N2O4可作为火箭推进剂的主要原因为_______ 。
(1)反应4HCl(浓)
 中,氧化剂是
中,氧化剂是(2)实验室用Na3CO3固体配制500 mL 1 mol/L的Na3CO3溶液。配制时必需的玻璃仪器有:烧杯、量筒、玻璃棒、
(3)在标准状况下,CO和CO2混合气体共33.6 L,质量为62 g,则两种气体的物质的量之和为
(4)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,实验室可用NaClO溶液与NH3反应制备联氨,反应的化学方程式为

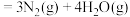 ,分析联氨和N2O4可作为火箭推进剂的主要原因为
,分析联氨和N2O4可作为火箭推进剂的主要原因为
您最近一年使用:0次
2021-03-04更新
|
200次组卷
|
2卷引用:湖南省长沙市一中2020-2021学年高一上学期期末考试化学试题
解题方法
9 . 根据信息完成下列各空:
(1)氢化钠(NaH)是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。
①氢化钠的电子式为___________ 。
②氢化钠与水反应的化学方程式为___________ ,反应的氧化剂为___________ 。该反应过 程中,被破坏的化学键有___________ (填数字序号,下同),形成的化学键有___________ 。
①离子键 ②极性共价键 ③非极性共价键
(2)MnO2可经过如图所示的转化制取 MnCO3,已知“反应Ⅱ”为复分解反应。
①写出“反应Ⅰ”的化学方程式:___________ 。

②写出“反应Ⅱ”的离子方程式:___________ 。
(1)氢化钠(NaH)是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。
①氢化钠的电子式为
②氢化钠与水反应的化学方程式为
①离子键 ②极性共价键 ③非极性共价键
(2)MnO2可经过如图所示的转化制取 MnCO3,已知“反应Ⅱ”为复分解反应。
①写出“反应Ⅰ”的化学方程式:

②写出“反应Ⅱ”的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 铟(In)作为种稀有贵金属在很多高新领域有广泛应用,随着铟的应用越来越广泛,人类对铟的需求量日益增加,有效富集回收铟的技术也越来越受到重视。回收处理含铟废渣[In的质量分数为9.8%,同时含有FeCl3、SiO2、SnO、Tl(OH)3杂质]是提高铟回收率的主要途径之一。
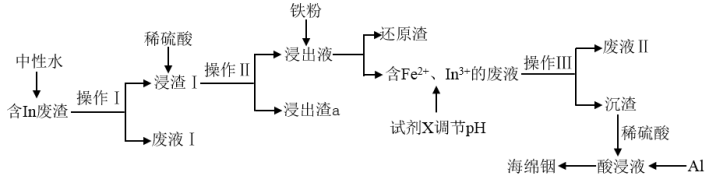
提示:①溶液中一些金属离子水解生成氢氧化物沉淀时的pH如表:
②“浸渣1”的主要成分为SnO、Tl(OH)3、SiO2、Fe(OH)3、In(OH)3。
(1)"操作III”的名称为__ 。
(2)"浸出渣a"的主要成分为__ (填化学式)。
(3)加入铁粉净化的最佳工艺控制溶液中硫酸含量为68.6g·L-1,则此时硫酸的物质的量浓度为__ mol·L-1,还原渣”的主要成分为Tl和Sn,写出反应生成Tl的离子方程式:__ 。
(4)加入试剂X调节pH的范围为__ 至__ ,可选择的试剂X为__ (填标号)。
A.Fe2O3 B.FeCO3 C.稀硫酸 D.稀硝酸
(5)“沉渣"中加入稀硫酸发生反应的化学方程式为__ 。
(6)通过加入铝置换出的海绵铟中铟的质量分数达到96.04%。通过以上途径回收铟的总损耗率约为2%,回收效率非常高。某企业每月可产生此种含铟废渣1600kg,利用上述技术手段,理论上可获得海绵铟的质量为__ kg。

提示:①溶液中一些金属离子水解生成氢氧化物沉淀时的pH如表:
金属离子 | Fe3+ | In3+ | Fe2+ |
开始沉淀pH | 2.0 | 2.9 | 7.15 |
沉淀完全pH | 3.2 | 5.0 | 8.15 |
(1)"操作III”的名称为
(2)"浸出渣a"的主要成分为
(3)加入铁粉净化的最佳工艺控制溶液中硫酸含量为68.6g·L-1,则此时硫酸的物质的量浓度为
(4)加入试剂X调节pH的范围为
A.Fe2O3 B.FeCO3 C.稀硫酸 D.稀硝酸
(5)“沉渣"中加入稀硫酸发生反应的化学方程式为
(6)通过加入铝置换出的海绵铟中铟的质量分数达到96.04%。通过以上途径回收铟的总损耗率约为2%,回收效率非常高。某企业每月可产生此种含铟废渣1600kg,利用上述技术手段,理论上可获得海绵铟的质量为
您最近一年使用:0次
2021-02-15更新
|
128次组卷
|
2卷引用:湖南省永州市第一中学2022-2023学年高三上学期第三次月考化学试题



