名校
1 . 工业上制备有机氟化剂SF4的反应为:3SCl2+4NaF===SF4+S2Cl2+4NaCl。下列说法正确的是
A. NaF既不做氧化剂也不做还原剂,SF4为氧化产物
B. SCl2与S2Cl2两种物质中的氯元素化合价不同
C. 制备反应中,氧化剂与还原剂物质的量之比为2∶1
D. 转移0.2 mol电子时,生成11.7 g NaCl
A. NaF既不做氧化剂也不做还原剂,SF4为氧化产物
B. SCl2与S2Cl2两种物质中的氯元素化合价不同
C. 制备反应中,氧化剂与还原剂物质的量之比为2∶1
D. 转移0.2 mol电子时,生成11.7 g NaCl
您最近半年使用:0次
2020-10-24更新
|
291次组卷
|
4卷引用:湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题
湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题(已下线)学科网2020年3月第一次在线大联考(山东卷)化学试题山东省枣庄滕州一中2021届高三10月月考化学试题(已下线)专题07 氧化还原反应分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
2 . KIO3是一种重要的化学试剂,可用作食盐中的补碘剂。其化工生产有多种方法,下面是“KClO3氧化法”制备KIO3的生产工艺流程图:
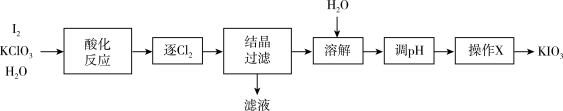
已知“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。下列相关说法正确的是

已知“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。下列相关说法正确的是
| A.“酸化反应”中,氧化剂与氧化产物的物质的量之比为6:11 |
| B.“逐Cl2”过程需要加入烧碱或KI晶体除Cl2 |
| C.借助食用醋和淀粉碘化钾试纸即可检验是否含有补碘剂 |
| D.操作X为蒸发结晶 |
您最近半年使用:0次
3 . 在室温下,发生下列几种反应:①16H++10Z-+2XO =2X2++5Z2+8H2O,②2A2++B2=2A3++2B-,③2B-+Z2=B2+2Z-。回答下列问题:
=2X2++5Z2+8H2O,②2A2++B2=2A3++2B-,③2B-+Z2=B2+2Z-。回答下列问题:
(1)要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入上面式子中的_____ 。
(2)在溶液中_____ (填“能”或“否”)发生反应8H++5A2++XO =X2++5A3++4H2O。
=X2++5A3++4H2O。
 =2X2++5Z2+8H2O,②2A2++B2=2A3++2B-,③2B-+Z2=B2+2Z-。回答下列问题:
=2X2++5Z2+8H2O,②2A2++B2=2A3++2B-,③2B-+Z2=B2+2Z-。回答下列问题:(1)要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入上面式子中的
(2)在溶液中
 =X2++5A3++4H2O。
=X2++5A3++4H2O。
您最近半年使用:0次
名校
解题方法
4 . 从化合价的角度认识氯的化合物。
(1)ClO2是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl
①该反应中,氧化剂是__________ ,氧化产物是_________ ,氧化剂和还原剂的物质的量之比为__________ ,依据氧化还原反应规律判断,氧化性强弱为NaClO3____ Cl2(填>、<或=)。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是____________ (填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
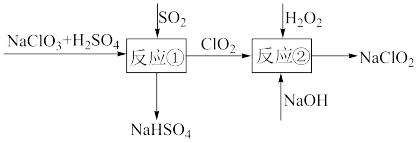
请将流程中发生的两个反应的离子方程式中所缺的物质补充完整:
反应① □ClO3-+□SO2=□ +□
+□________
反应② □ ClO2+□H2O2+□________ =□ +□O2↑+□
+□O2↑+□________
(1)ClO2是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl
①该反应中,氧化剂是
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(
 ),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是a.FeSO4 b.O3 c.KMnO4 d.SO2
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:

请将流程中发生的两个反应的离子方程式中所缺的物质补充完整:
反应① □ClO3-+□SO2=□
 +□
+□反应② □ ClO2+□H2O2+□
 +□O2↑+□
+□O2↑+□
您最近半年使用:0次
2020-10-20更新
|
294次组卷
|
8卷引用:湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题
解题方法
5 . 下列描述中所发生化学反应对应的离子方程式正确的是
A.KClO的碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2 +3Cl-+4H++H2O +3Cl-+4H++H2O |
B.将二氧化硫通入氯化铁溶液中:SO2+2Fe3++2H2O= +2Fe2++4H+ +2Fe2++4H+ |
| C.向溴化亚铁溶液中通入足量氯气:2Fe2++Cl2=2Fe3++2Cl- |
D.用酸性高锰酸钾标准溶液滴定草酸:2 +16H++5 +16H++5 =2Mn2++10CO2↑+8H2O =2Mn2++10CO2↑+8H2O |
您最近半年使用:0次
2020-10-18更新
|
404次组卷
|
2卷引用:湖南省长沙市明达中学2022届高三上学期入学考试化学试题
名校
解题方法
6 . 工业生产中高锰酸钾广泛用作氧化剂。以二氧化锰为原料制取高锰酸钾晶体的流程如下:
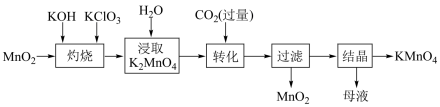
下列说法正确的是

下列说法正确的是
| A.“灼烧”时使用石英坩埚 |
| B.“转化”过程生成KMnO4和MnO2的物质的量之比为2:1 |
| C.母液中含有的溶质主要是KHCO3 |
| D.上述流程中可以循环利用的物质有3种 |
您最近半年使用:0次
2020-10-17更新
|
254次组卷
|
2卷引用:湖南省岳阳县第一中学2022届高三下学期期中考试化学试题
名校
7 . 现有①KMnO4;②H2;③O2;④Cl2;⑤CO;⑥Al六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲: 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:
(1)甲中有__________ ;乙中有__________ 。(填序号)
(2)由Fe Fe3O4,Fe2O3
Fe3O4,Fe2O3 Fe可知,欲实现Ⅰ反应过程应从
Fe可知,欲实现Ⅰ反应过程应从__________ (填“甲”或“乙”,下同)中找物质,欲实现Ⅱ反应过程应从__________ 中找物质。
(3)请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并用双线桥法标出电子转移的方向和数目。__________ +__________ =__________ +__________ ,____________________________ 。
 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:(1)甲中有
(2)由Fe
 Fe3O4,Fe2O3
Fe3O4,Fe2O3 Fe可知,欲实现Ⅰ反应过程应从
Fe可知,欲实现Ⅰ反应过程应从(3)请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并用双线桥法标出电子转移的方向和数目。
您最近半年使用:0次
2020-10-17更新
|
49次组卷
|
2卷引用:湖南省中方县第一中学2020-2021学年高一上学期12月月考化学试题
8 . 工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2) ,发生如下图所示过程。下列说法错误的是
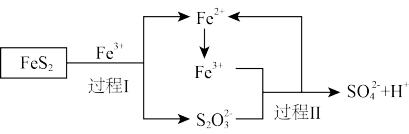

| A.过程I每溶解120gFeS2,理论上消耗6molFe3+ |
B.过程II每生成1 mol ,转移8 mol e- ,转移8 mol e- |
C.总反应为FeS2 +14Fe3+ +8H2O=2 +15Fe2+ +16H+ +15Fe2+ +16H+ |
| D.反应过程中某些步骤可通过鼓入空气实现 |
您最近半年使用:0次
名校
9 . 氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因:_______ 。
(2)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_______ 。
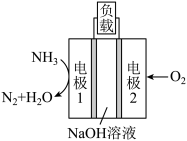
(3)某液氨——液氧燃料电池示意图如图,该燃料电池的工作效率为50%,现用作电源电解500 mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为______ (假设溶液电解前后体积不变)。
(1)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因:
(2)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为
(3)某液氨——液氧燃料电池示意图如图,该燃料电池的工作效率为50%,现用作电源电解500 mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为

您最近半年使用:0次
名校
10 . I、某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为 + 3
+ 3 = 3
= 3 + I- + 3H+,则第二步反应的离子方程式为
+ I- + 3H+,则第二步反应的离子方程式为____ 。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
①实验①②是探究____ 对反应速率的影响;
②实验①③是探究温度对反应速率的影响,表中a=_____ ,b=_____ 。
II、某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式______ ;
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4) =_______ mol/(L·min)。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为
 + 3
+ 3 = 3
= 3 + I- + 3H+,则第二步反应的离子方程式为
+ I- + 3H+,则第二步反应的离子方程式为(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
①实验①②是探究
②实验①③是探究温度对反应速率的影响,表中a=
II、某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4) =
您最近半年使用:0次
2020-10-10更新
|
198次组卷
|
3卷引用:湖南省衡阳市第八中学2020-2021学年高二上学期10月月考化学试题



