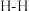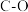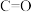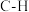解题方法
1 . 工业上常用合成气(主要成分为CO、 )在一定条件下制备甲醇,其涉及反应如下:
)在一定条件下制备甲醇,其涉及反应如下:
反应Ⅰ.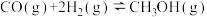
 ;
;
反应Ⅱ.
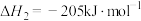 ;
;
反应Ⅲ.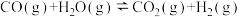
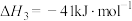 。
。
回答下列问题:
(1)在催化剂作用下也可以由CO2制备甲醇: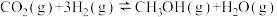
 ,则
,则
______  ;该反应在
;该反应在______ (填“高温”“低温”或“任意温度”)下可自发进行。
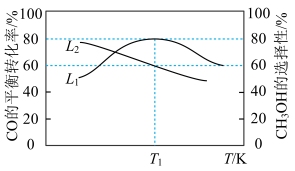
(2)向容积为2 L的刚性密闭容器中充入2 mol CO和4 mol 发生上述反应,测得不同温度下,CO的平衡转化率、
发生上述反应,测得不同温度下,CO的平衡转化率、 的选择性如图所示
的选择性如图所示 。
。______ (填“ ”或“
”或“ ”)。
”)。
②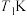 下,2 min时达到平衡,此时体系压强为aPa,
下,2 min时达到平衡,此时体系压强为aPa,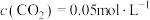 。用
。用 的分压变化表示的化学反应速率为
的分压变化表示的化学反应速率为______ 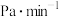 ,反应Ⅲ的
,反应Ⅲ的
______ ( ,指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
,指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压 的物质的量分数)。
的物质的量分数)。
(3)维持CO和 的物质的量之和为3 mol,若在1 L恒容密闭容器中只发生上述反应Ⅰ,调整进气比
的物质的量之和为3 mol,若在1 L恒容密闭容器中只发生上述反应Ⅰ,调整进气比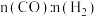 不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度:
不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度: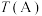
______ (填“<”“>”或“=”) ,其判断依据是
,其判断依据是______ 。
 )在一定条件下制备甲醇,其涉及反应如下:
)在一定条件下制备甲醇,其涉及反应如下:反应Ⅰ.
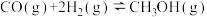
 ;
;反应Ⅱ.

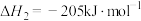 ;
;反应Ⅲ.
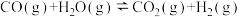
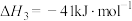 。
。回答下列问题:
(1)在催化剂作用下也可以由CO2制备甲醇:
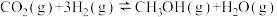
 ,则
,则
 ;该反应在
;该反应在(2)向容积为2 L的刚性密闭容器中充入2 mol CO和4 mol
 发生上述反应,测得不同温度下,CO的平衡转化率、
发生上述反应,测得不同温度下,CO的平衡转化率、 的选择性如图所示
的选择性如图所示 。
。
 ”或“
”或“ ”)。
”)。②
 下,2 min时达到平衡,此时体系压强为aPa,
下,2 min时达到平衡,此时体系压强为aPa, 。用
。用 的分压变化表示的化学反应速率为
的分压变化表示的化学反应速率为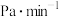 ,反应Ⅲ的
,反应Ⅲ的
 ,指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
,指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压 的物质的量分数)。
的物质的量分数)。(3)维持CO和
 的物质的量之和为3 mol,若在1 L恒容密闭容器中只发生上述反应Ⅰ,调整进气比
的物质的量之和为3 mol,若在1 L恒容密闭容器中只发生上述反应Ⅰ,调整进气比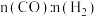 不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度:
不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度: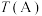
 ,其判断依据是
,其判断依据是
您最近半年使用:0次
2 . (1)已知:
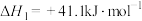


写出 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:___________ ;
(2)恒温条件下,可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ ;
A.单位时间内生成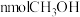 的同时生成
的同时生成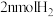
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E. 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为___________ ;
②如表所列数据是反应在不同温度下的化学平衡常数( )
)
a.由表中数据判断该反应的
___________ 0(填“>”、“=”或“<”);
b.某温度下,将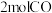 和
和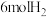 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为___________ ,此时的温度为___________ ;
③要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是___________ ;
a.升温 b.加入催化剂 c.增加 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇

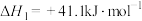


写出
 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:(2)恒温条件下,可逆反应:
 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成
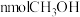 的同时生成
的同时生成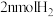
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.
 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为
②如表所列数据是反应在不同温度下的化学平衡常数(
 )
)| 温度 | 250℃ | 300℃ | 350℃ |
 | 2.041 | 0.270 | 0.012 |

b.某温度下,将
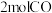 和
和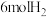 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为③要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.升温 b.加入催化剂 c.增加
 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇
您最近半年使用:0次
名校
解题方法
3 . 甲烷( )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:
(1)实验测得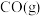 与
与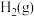 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量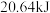 ,则该反应的热化学方程式为
,则该反应的热化学方程式为______________________ 。
(2)已知有关物质的化学键键能数据如下:
试计算反应 的焓变等于
的焓变等于___________ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:_______________ 。
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是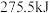 ,硫的燃烧热为
,硫的燃烧热为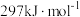 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为___________ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:______________ 。
 )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:(1)实验测得
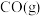 与
与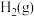 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量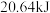 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知有关物质的化学键键能数据如下:
化学链 |
|
|
|
|
|
键能/ | 436 | 343 | 805 | 413 | 465 |
 的焓变等于
的焓变等于(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
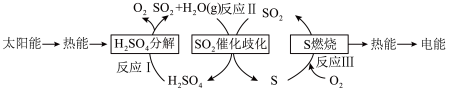
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是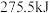 ,硫的燃烧热为
,硫的燃烧热为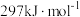 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:

您最近半年使用:0次
名校
解题方法
4 . 科学研究表明: 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
回答下列问题:
(1)①过程
___________ (填“吸收”或“放出”)能量。
②反应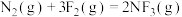
 =
=___________ 。
(2)已知:
①
 ;
;
②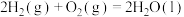
 。
。
现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为___________ 。
(3)电石(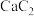 )可通过下列反应制备:
)可通过下列反应制备:
①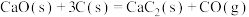
 ;
;
②
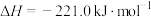 。
。
若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g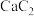 ,投料的量为56g CaO及
,投料的量为56g CaO及___________ mol C、___________ mol  。
。
 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)| 化学键 | N≡N | F—F | N—F |
键能( ) ) | 946 | 154 | 283 |
(1)①过程

②反应
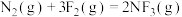
 =
=(2)已知:
①

 ;
;②
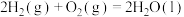
 。
。现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成
 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为(3)电石(
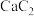 )可通过下列反应制备:
)可通过下列反应制备:①
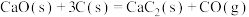
 ;
;②

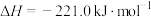 。
。若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g
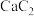 ,投料的量为56g CaO及
,投料的量为56g CaO及 。
。
您最近半年使用:0次
5 . 化学反应过程中都伴随能量变化,吸热或放热是化学反应中能量变化的重要形式。回答下列问题:
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键___________ ,断裂化学键___________ 。
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应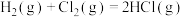 的
的 =
=___________  。
。
(3)已知: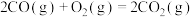
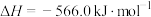 ;
;
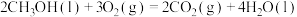
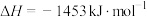 。
。
则 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为___________ 。
(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol (l)的反应热
(l)的反应热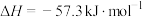 。
。
①表示稀硫酸与稀烧碱溶液生成1mol (l)的热化学方程式为
(l)的热化学方程式为___________ 。
②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的
___________ (填“偏大”或“偏小”)。
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应
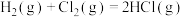 的
的 =
= 。
。(3)已知:
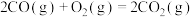
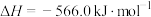 ;
;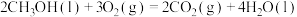
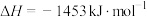 。
。则
 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol
 (l)的反应热
(l)的反应热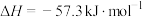 。
。①表示稀硫酸与稀烧碱溶液生成1mol
 (l)的热化学方程式为
(l)的热化学方程式为②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的

您最近半年使用:0次
名校
解题方法
6 . 已知 (g)和
(g)和 (l)的燃烧热分别是1411.0
(l)的燃烧热分别是1411.0 和1366.8
和1366.8 ,则反应
,则反应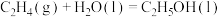 的
的 为
为
 (g)和
(g)和 (l)的燃烧热分别是1411.0
(l)的燃烧热分别是1411.0 和1366.8
和1366.8 ,则反应
,则反应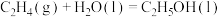 的
的 为
为A.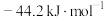 | B.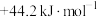 | C.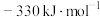 | D. |
您最近半年使用:0次
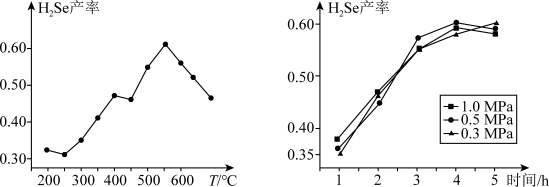
7 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近半年使用:0次
名校
解题方法
8 . 乙烯是重要的工业原料,可用下列方法制备。
Ⅰ. 催化加氢法制乙烯:
催化加氢法制乙烯:
已知: 的燃烧热分别为:
的燃烧热分别为: ;
;

(1)该反应
___________  。
。
(2)将 和
和 按物质的量之比为2:3充入恒容密闭容器中,分别在不同催化剂条件下发生反应,测得相同时间
按物质的量之比为2:3充入恒容密闭容器中,分别在不同催化剂条件下发生反应,测得相同时间 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:___________ 。
A.达平衡时,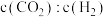 一定为2:3
一定为2:3
B.向反应体系中加入少量无水 固体,可提高
固体,可提高 的产率
的产率
C.b、d两状态下,化学反应速率一定相等
D.使用催化剂Ⅰ时反应的活化能比使用催化剂Ⅱ时低
E. 温度下,向容器中加入稀有气体,可提高
温度下,向容器中加入稀有气体,可提高 的转化率
的转化率
Ⅱ.工业上也可用甲烷催化法制取乙烯,只发生如下反应: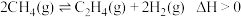 。
。
(3)温度T时,向2L的恒容反应器中充入 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示: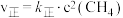 ,
,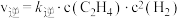 ,
,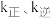 为速率常数,只与温度有关,T温度时,
为速率常数,只与温度有关,T温度时,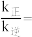
___________ (用含有x的代数式表示);当温度升高时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m___________ (填“>”“<”或“=”)n。
Ⅲ. 氧化
氧化 制乙烯:
制乙烯:
主反应为: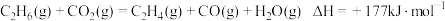
(4)某催化剂催化过程中,在催化剂表面发生了一系列反应:
①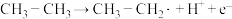 ,
,
②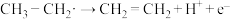 ,
,
③ ,
,
④___________。
则:④的反应式为___________ 。
(5)在 与
与 反应制
反应制 的过程中,
的过程中,
还会发生副反应:
①其他条件相同时,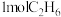 与
与 经相同反应时间测得如表实验数据:
经相同反应时间测得如表实验数据:
相同温度时,催化剂2催化下 产率更高的原因是
产率更高的原因是___________ 。
②在容器体积为1.0L,充入 和
和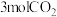 同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性(
同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性(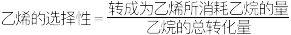 )与温度、压强的关系如图所示。M点主反应的平衡常数为
)与温度、压强的关系如图所示。M点主反应的平衡常数为___________ (结果保留2位有效数字)。
Ⅰ.
 催化加氢法制乙烯:
催化加氢法制乙烯: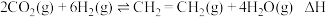
已知:
 的燃烧热分别为:
的燃烧热分别为: ;
;
(1)该反应

 。
。(2)将
 和
和 按物质的量之比为2:3充入恒容密闭容器中,分别在不同催化剂条件下发生反应,测得相同时间
按物质的量之比为2:3充入恒容密闭容器中,分别在不同催化剂条件下发生反应,测得相同时间 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示: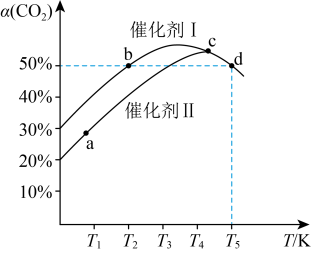
A.达平衡时,
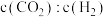 一定为2:3
一定为2:3B.向反应体系中加入少量无水
 固体,可提高
固体,可提高 的产率
的产率C.b、d两状态下,化学反应速率一定相等
D.使用催化剂Ⅰ时反应的活化能比使用催化剂Ⅱ时低
E.
 温度下,向容器中加入稀有气体,可提高
温度下,向容器中加入稀有气体,可提高 的转化率
的转化率Ⅱ.工业上也可用甲烷催化法制取乙烯,只发生如下反应:
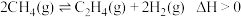 。
。(3)温度T时,向2L的恒容反应器中充入
 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:
 ,
,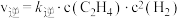 ,
,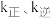 为速率常数,只与温度有关,T温度时,
为速率常数,只与温度有关,T温度时,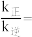
 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则mⅢ.
 氧化
氧化 制乙烯:
制乙烯:主反应为:
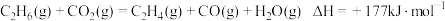
(4)某催化剂催化过程中,在催化剂表面发生了一系列反应:
①
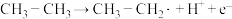 ,
,②
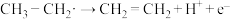 ,
,③
 ,
,④___________。
则:④的反应式为
(5)在
 与
与 反应制
反应制 的过程中,
的过程中,还会发生副反应:

①其他条件相同时,
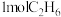 与
与 经相同反应时间测得如表实验数据:
经相同反应时间测得如表实验数据:| 实验 | 温度/K | 催化剂 |  的产率% 的产率% |
| 实验1 | 400 | 催化剂1 | 55.0 |
| 400 | 催化剂2 | 62.3 | |
| 实验2 | 500 | 催化剂1 | 68.5 |
| 500 | 催化剂2 | 80.1 |
 产率更高的原因是
产率更高的原因是②在容器体积为1.0L,充入
 和
和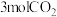 同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性(
同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性(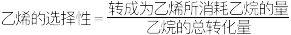 )与温度、压强的关系如图所示。M点主反应的平衡常数为
)与温度、压强的关系如图所示。M点主反应的平衡常数为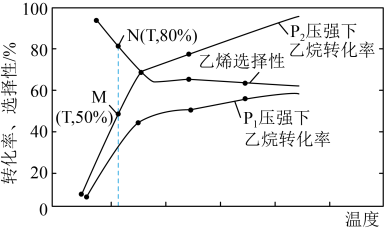
您最近半年使用:0次
9 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)已知: 、
、 和
和 键的键能分别为
键的键能分别为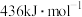 、
、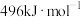 和
和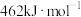 。
。

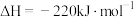

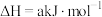
则
___________ 。
(2)已知: 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。___________ (填I或II)时,反应过程中 所能达到的最高浓度更大。
所能达到的最高浓度更大。
②在相同条件下反应达到平衡状态,为提高 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是___________ 。
(3)以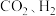 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.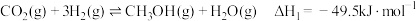
II.
在密闭容器中,压强恒为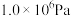 ,
,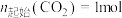 ,
,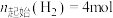 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。 的选择性可表示为
的选择性可表示为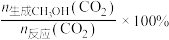 。
。
①反应的最佳温度___________ 。
②反应温度超过 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是___________ 。
③反应温度超过 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是___________ 。
④反应温度在 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时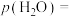
___________ 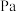 (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数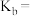
___________ 。
(4)工业废气中含有的 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。___________ 。
②装置b中,x和y为石墨电极,写出电极x的电极反应___________ 。
(1)已知:
 、
、 和
和 键的键能分别为
键的键能分别为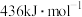 、
、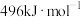 和
和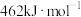 。
。
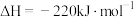

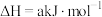
则

(2)已知:
 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。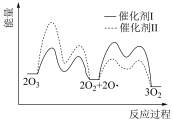
 所能达到的最高浓度更大。
所能达到的最高浓度更大。②在相同条件下反应达到平衡状态,为提高
 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是(3)以
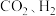 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
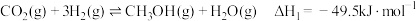
II.

在密闭容器中,压强恒为
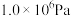 ,
,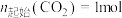 ,
,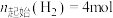 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。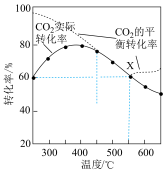
 的选择性可表示为
的选择性可表示为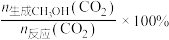 。
。①反应的最佳温度
②反应温度超过
 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是③反应温度超过
 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是④反应温度在
 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时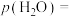
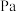 (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数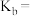
(4)工业废气中含有的
 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。
②装置b中,x和y为石墨电极,写出电极x的电极反应
您最近半年使用:0次
10 . 氙及其化合物在工业生产中有重要用途。
(1)1962年,化学家巴特利特合成了氙的第一个化合物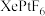 ,其在熔化时电离出
,其在熔化时电离出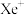 和
和 。Xe和
。Xe和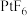 混合制得
混合制得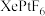 的反应可以表示如下:
的反应可以表示如下: )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能,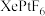 的晶格能为
的晶格能为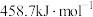 。
。
②Xe的第一电离能为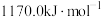 。
。
③
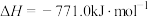 。
。
根据以上信息,计算反应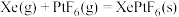

___________  。
。
(2)不久,在三个不同实验室里又分别合成了 、
、 、
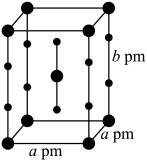
、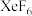 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为___________ ,中心原子的价层电子对数为___________ ,晶体密度为___________  。
。 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
已知:分压=总压×该组分物质的量分数;
对于反应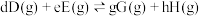
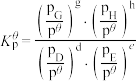
其中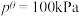 ,
,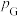 、
、 、
、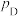 、
、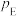 为各组分的平衡分压。
为各组分的平衡分压。
①
___________ 0(填“>”或“<”)。为提高平衡混合物中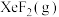 的含量,应
的含量,应___________ 投料比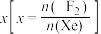 (填“增大”或“减小”)。
(填“增大”或“减小”)。
②673K时充入23.77molXe和 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:
则 平衡转化率
平衡转化率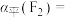
___________ (保留三位有效数字),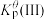
___________ 。
(1)1962年,化学家巴特利特合成了氙的第一个化合物
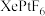 ,其在熔化时电离出
,其在熔化时电离出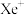 和
和 。Xe和
。Xe和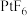 混合制得
混合制得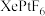 的反应可以表示如下:
的反应可以表示如下: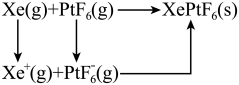
 )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能,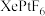 的晶格能为
的晶格能为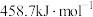 。
。②Xe的第一电离能为
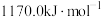 。
。③

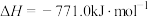 。
。根据以上信息,计算反应
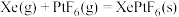

 。
。(2)不久,在三个不同实验室里又分别合成了
 、
、 、
、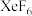 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为 。
。
 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
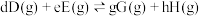
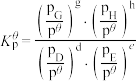
其中
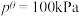 ,
,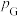 、
、 、
、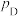 、
、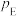 为各组分的平衡分压。
为各组分的平衡分压。标准压强平衡常数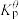 反应平衡 | 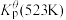 | 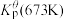 |
反应I: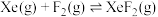  | 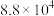 | 360 |
反应II: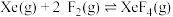  | ||
反应III: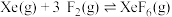  | 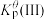 |

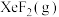 的含量,应
的含量,应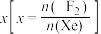 (填“增大”或“减小”)。
(填“增大”或“减小”)。②673K时充入23.77molXe和
 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:| 化学式 |  |  | 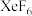 |
| 物质的量/mol | 3.60 | 19.80 | 0.36 |
 平衡转化率
平衡转化率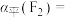
您最近半年使用:0次