20-21高一·浙江·阶段练习
解题方法
1 . 以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将相MnO2 (含有较多MnO和MnCO3)样品转化为纯MnO2实验。以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将相MnO2 (含有较多MnO和MnCO3)样品转化为纯MnO2实验。
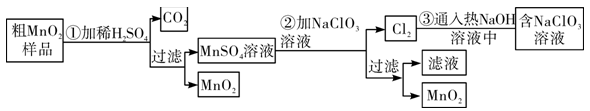
针对上述工业流程,下列选项错误的是

针对上述工业流程,下列选项错误的是
| A.第①步加稀H2SO4时,粗MnO2样品中的MnO和MnCO3转化为可溶性物质 |
| B.不考虑操作过程中的损失,本流程中的NaClO3固体能全部循环,不需额外补充 |
C.第②步反应的离子方程式5Mn2++2 +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.实验室模拟上述工业流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、 漏斗 |
您最近一年使用:0次
19-20高一·浙江绍兴·期末
名校
解题方法
2 . 某学习小组设计实验制备氮化锂(Li3N)并测定其纯度,装置如下所示:
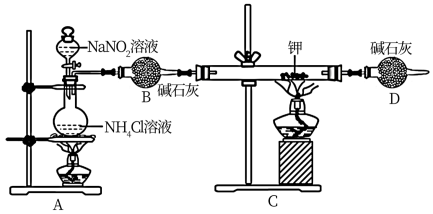
已知:i.Li3N遇水剧烈反应。
ii.实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
请回答:
(1)写出制备N2的化学方程式_______ 。
(2)仪器B的名称为_______ ;D装置的作用是_______ 。
(3)实验室将金属钠和理均可保仔在_______ 中(填相应的编号)。
a.乙醇(CH3CH2OH) b.煤油c.石蜡油d.苯
(4)测定Li3N产品纯度:取m gLi3N产品按下图所示装置进行实验。
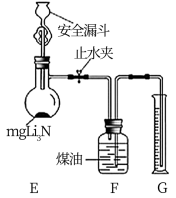
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得气体体积为V L(已折合成标准状况下)。
①安全漏斗中“安全”含义是_______ 。
②Li3N与水反应的化学方程式_______ 。
③读数前调平F和G中液面的目的是_______ 。
④该Li3N产品的纯度为_______ %(只列出含m和V的计算式,不必计算化简)。
⑤若Li3N产品混有Li,则测得纯度_______ (选填“偏高”、“偏低”或“无影响")。(已知Li3N的相对分子质量为35)

已知:i.Li3N遇水剧烈反应。
ii.实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
请回答:
(1)写出制备N2的化学方程式
(2)仪器B的名称为
(3)实验室将金属钠和理均可保仔在
a.乙醇(CH3CH2OH) b.煤油c.石蜡油d.苯
(4)测定Li3N产品纯度:取m gLi3N产品按下图所示装置进行实验。

打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得气体体积为V L(已折合成标准状况下)。
①安全漏斗中“安全”含义是
②Li3N与水反应的化学方程式
③读数前调平F和G中液面的目的是
④该Li3N产品的纯度为
⑤若Li3N产品混有Li,则测得纯度
您最近一年使用:0次
3 . Ⅰ.某科学探究小组设计以下装置依次完成氯气的制备、氯酸钠的制备、次氯酸钠的制备并探究氯水的性质。
其中:①为氯气发生装置,烧瓶中盛放 MnO2 固体;
②的试管里盛有 15 mL 30% NaOH 溶液,并置于热水浴中;
③的试管里盛有 15 mL 8% NaOH 溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置。
请填写下列空白:
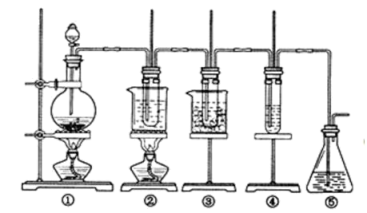
(1)如何检验装置①的气密性______ 。
(2)如果实验室没有 MnO2,下列物质可以用来代替 MnO2制 Cl2的是__
A.KMnO4 B.Fe2O3 C.浓硫酸 D.KClO3
(3)制备氯酸钠的化学方程式为____ 。
(4)比较制取氯酸钠和次氯酸钠的条件,二者的差异是:_____ 。
(5)④的试管里紫色石蕊试液现象及原因___________ 。
Ⅱ.(6)次氯酸钠溶液可以杀灭新冠病毒,若将其与稀硫酸混合使用可增强消毒能力。现用18mol·L-1 浓硫酸来配制 450 mL 0.2 mol·L-1 的稀硫酸。
①需用量筒量取浓硫酸的体积为___________ mL。
②定容时的操作:当液面离容量瓶颈部的刻度线 1~2cm 时,___________ ,盖好瓶塞,反复上下颠倒,摇匀。
③若所配制的稀硫酸浓度偏高,则下列可能的原因分析中正确的是___________ 。
A.配制前,容量瓶用蒸馏水洗涤后再用硫酸润洗
B.量取浓硫酸时,读数时俯视液体的凹液面
C.浓硫酸稀释后立即转移至容量瓶定容
D.颠倒摇匀后,液面低于刻度线,继续滴加蒸馏水
其中:①为氯气发生装置,烧瓶中盛放 MnO2 固体;
②的试管里盛有 15 mL 30% NaOH 溶液,并置于热水浴中;
③的试管里盛有 15 mL 8% NaOH 溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置。
请填写下列空白:

(1)如何检验装置①的气密性
(2)如果实验室没有 MnO2,下列物质可以用来代替 MnO2制 Cl2的是
A.KMnO4 B.Fe2O3 C.浓硫酸 D.KClO3
(3)制备氯酸钠的化学方程式为
(4)比较制取氯酸钠和次氯酸钠的条件,二者的差异是:
(5)④的试管里紫色石蕊试液现象及原因
Ⅱ.(6)次氯酸钠溶液可以杀灭新冠病毒,若将其与稀硫酸混合使用可增强消毒能力。现用18mol·L-1 浓硫酸来配制 450 mL 0.2 mol·L-1 的稀硫酸。
①需用量筒量取浓硫酸的体积为
②定容时的操作:当液面离容量瓶颈部的刻度线 1~2cm 时,
③若所配制的稀硫酸浓度偏高,则下列可能的原因分析中正确的是
A.配制前,容量瓶用蒸馏水洗涤后再用硫酸润洗
B.量取浓硫酸时,读数时俯视液体的凹液面
C.浓硫酸稀释后立即转移至容量瓶定容
D.颠倒摇匀后,液面低于刻度线,继续滴加蒸馏水
您最近一年使用:0次
名校
4 . ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对制备ClO2、并在吸收、释放和应用进行了研究。
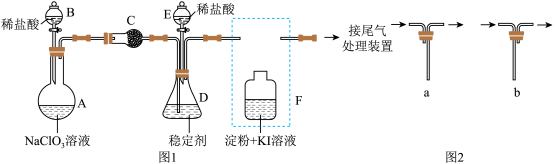
(1)仪器D的名称是_______ 。安装F中导管时,应选用图2中的_______ 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是_______ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_______ 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_______ ,原因是_______ 。

(1)仪器D的名称是
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是

您最近一年使用:0次
2021-01-19更新
|
128次组卷
|
3卷引用:【浙江新东方】在线化学64高一下
21-22高一上·浙江·阶段练习
5 . ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如下图装置(夹持装置略)对ClO2制备、吸收、释放和应用进行了研究。打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,
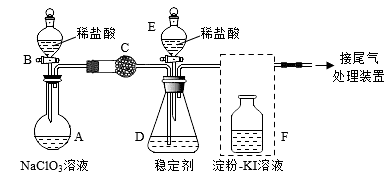
(1)NaClO3溶液的配制
①实验需要0.1mol·L-1的NaClO3溶液480mL,(NaClO3的相对分子质量为106.5)需要用托盘天平称NaClO3__ 克,配制溶液过程中,需用到的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、___ 。
②在配制过程中,下列操作会导致所配溶液浓度偏低的是_____ 。
A.某学生观察定容时仰视刻度线
B.称量时所用的砝码已经生锈
C.摇匀后,发现液面低于刻度线,再加蒸馏水
D.转移溶液前容量瓶内有少量蒸馏水
(2)仪器B名称是______ 。关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是______ 。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____ 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_____ 。
(4)已吸收ClO2气体的稳定剂I和稳定剂II,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是____ 。


(1)NaClO3溶液的配制
①实验需要0.1mol·L-1的NaClO3溶液480mL,(NaClO3的相对分子质量为106.5)需要用托盘天平称NaClO3
②在配制过程中,下列操作会导致所配溶液浓度偏低的是
A.某学生观察定容时仰视刻度线
B.称量时所用的砝码已经生锈
C.摇匀后,发现液面低于刻度线,再加蒸馏水
D.转移溶液前容量瓶内有少量蒸馏水
(2)仪器B名称是
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(4)已吸收ClO2气体的稳定剂I和稳定剂II,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是

您最近一年使用:0次
21-22高一上·浙江·阶段练习
解题方法
6 . 在常温下,Fe 与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,完成高温下“Fe与水蒸气的反应实验”然后对产物进行检验。请回答该实验中的问题。
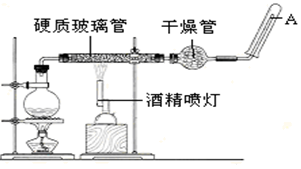
(1)写出该反应的化学方程式______
(2)实验开始时应先点燃_______ ,实验结束时应先熄灭_______ 。
(3)该同学探究反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出有关变色反应的化学方程式_______ 。
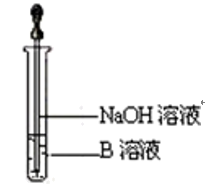
氢氧化亚铁具有强还原性极容易被氧化变色:写出一种实验制备氢氧化亚铁防止氧化的措施:______ 。
(4)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有还原性。由此可知,实验室中含Fe2+盐溶液现用现配制的原因_______ ,并且配制含Fe2+的盐溶液时应加入少量 _______ ,检验硫酸铁盐溶液中是否含有硫酸亚铁盐的方法是 _______ 。

(1)写出该反应的化学方程式
(2)实验开始时应先点燃
(3)该同学探究反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出有关变色反应的化学方程式

氢氧化亚铁具有强还原性极容易被氧化变色:写出一种实验制备氢氧化亚铁防止氧化的措施:
(4)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有还原性。由此可知,实验室中含Fe2+盐溶液现用现配制的原因
您最近一年使用:0次
21-22高一上·浙江·阶段练习
7 . FeBr2是一种黄绿色固体,某学习小组制备并研究它的性质:
I.实验室制备FeBr2。实验室用如图所示装置制取溴化亚铁,其中A为CO2发生装置,D和d中均有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时先将干燥、纯净的CO2通入装置中,然后将铁粉加热至600~700℃,再不断将d中液溴滴入100 ℃~120℃ 的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色片状溴化亚铁。

请回答:
(1)若在A中盛固体碳酸钙,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处装置的试剂分别为_______ ;_______ 。
(2)不断通入CO2的主要作用:①_______ ;②_______ 。
(3)该套装置存在明显缺陷,请改进:_______ 。
II.配制FeBr2溶液
(1)实验需要450mL0.1mol/LFeBr2溶液,配制FeBr2溶液除烧杯、量筒、玻璃棒外还需的玻璃仪器是_______ 。需要用托盘天平称取_______ 克FeBr2固体。
(2)下列情况会使所配制的溶液的浓度偏大的有_______ 。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
E.未用蒸馏水洗涤烧杯和玻璃棒
III.探究FeBr2的性质
(1)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色,某同学对产生黄色的原因提出了两个假设:
假设1:_______ ;
假设2:Fe2+被 Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______ 。
(2)在10mL上述FeBr2溶液中通入44. 8mL(标况) Cl2,则反应的离子方程式为_______ 。
(3)为防止FeBr2溶液被氧化,可加入试剂_______ 。
I.实验室制备FeBr2。实验室用如图所示装置制取溴化亚铁,其中A为CO2发生装置,D和d中均有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时先将干燥、纯净的CO2通入装置中,然后将铁粉加热至600~700℃,再不断将d中液溴滴入100 ℃~120℃ 的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色片状溴化亚铁。

请回答:
(1)若在A中盛固体碳酸钙,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处装置的试剂分别为
(2)不断通入CO2的主要作用:①
(3)该套装置存在明显缺陷,请改进:
II.配制FeBr2溶液
(1)实验需要450mL0.1mol/LFeBr2溶液,配制FeBr2溶液除烧杯、量筒、玻璃棒外还需的玻璃仪器是
(2)下列情况会使所配制的溶液的浓度偏大的有
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
E.未用蒸馏水洗涤烧杯和玻璃棒
III.探究FeBr2的性质
(1)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色,某同学对产生黄色的原因提出了两个假设:
假设1:
假设2:Fe2+被 Cl2氧化成Fe3+。
设计实验证明假设2是正确的
(2)在10mL上述FeBr2溶液中通入44. 8mL(标况) Cl2,则反应的离子方程式为
(3)为防止FeBr2溶液被氧化,可加入试剂
您最近一年使用:0次
20-21高一上·浙江绍兴·阶段练习
名校
解题方法
8 . 氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,其中制取SOCl2在三颈烧瓶中进行。回答以下问题:
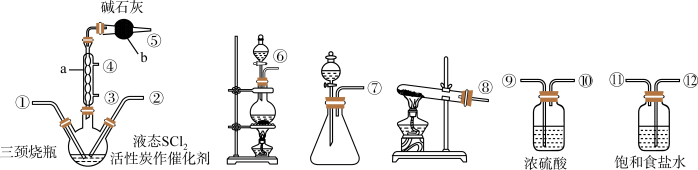
已知:①SOCl2沸点为78.8℃,SCl2的沸点为50℃,且两种液体可互溶。②SOCl2遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生。
(1)部分所选仪器的连接顺序是:⑥→______ 、______ 、______ 、______ →①,制Cl2的离子方程式为______ 。
(2)仪器a的进水口为______ (填③或④),仪器b的作用是______ 。
(3)本实验中制取SO2在锥形瓶中进行,常用70%的硫酸和亚硫酸钠固体制取二氧化硫,而不是用98%的浓硫酸或稀硫酸的原因是______ 。
(4)SOCl2 与NaOH的水反应,生成三种盐,且其中两种含硫元素盐的物质的量相同,则反应的化学方程式为______ 。
(5)实验结束后,从三颈烧瓶回收活性炭催化剂的实验操作名称是______ ,获取纯净的 SOCl2的实验操作名称是______ , 若反应中消耗MnO2质量为3.48 g (设盐酸、SO2足量,生成的氯气全部逸出),最后得到纯净的SOCl2 6.00 g,则SOCl2的产率为______ 。

已知:①SOCl2沸点为78.8℃,SCl2的沸点为50℃,且两种液体可互溶。②SOCl2遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生。
(1)部分所选仪器的连接顺序是:⑥→
(2)仪器a的进水口为
(3)本实验中制取SO2在锥形瓶中进行,常用70%的硫酸和亚硫酸钠固体制取二氧化硫,而不是用98%的浓硫酸或稀硫酸的原因是
(4)SOCl2 与NaOH的水反应,生成三种盐,且其中两种含硫元素盐的物质的量相同,则反应的化学方程式为
(5)实验结束后,从三颈烧瓶回收活性炭催化剂的实验操作名称是
您最近一年使用:0次
20-21高一上·浙江绍兴·阶段练习
解题方法
9 . 纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
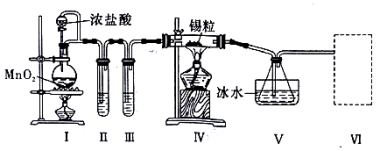
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。请根据上图装置回答下列问题:
(1)装置I中发生反应的离子方程式为___________ 。
(2)装置II中的试剂是___________ ,装置V的作用是___________ 。
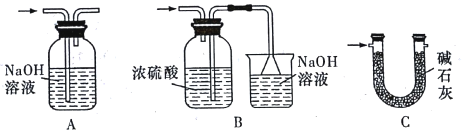
(3)装置VI最好选用下列装置中的___________ (填标号)。
(4)实验结束后,欲回收利用装置I中未反应完的MnO2,需要的分离方法是___________ 。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________ (填字母)。
A.先点燃I处酒精灯,后点燃IV处酒精灯
B.先点燃IV处酒精灯,后点燃I处酒精灯
C.同时点燃I、IV两处酒精灯

已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。请根据上图装置回答下列问题:
(1)装置I中发生反应的离子方程式为
(2)装置II中的试剂是
(3)装置VI最好选用下列装置中的

(4)实验结束后,欲回收利用装置I中未反应完的MnO2,需要的分离方法是
(5)为了顺利完成实验,点燃酒精灯的正确操作是
A.先点燃I处酒精灯,后点燃IV处酒精灯
B.先点燃IV处酒精灯,后点燃I处酒精灯
C.同时点燃I、IV两处酒精灯
您最近一年使用:0次
2021-01-02更新
|
209次组卷
|
4卷引用:【浙江新东方】绍兴qw78
名校
10 . 以MgO、C、Cl2为原料在加热条件下制取无水氯化镁,产物之一为可燃性气体。已知氯化镁冷却过程中易吸收水蒸气生成结晶水合物。
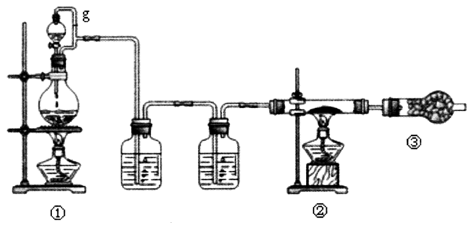
(1)①装置发生反应的离子方程式___ 。②装置中发生反应的化学方程式___ 。
(2)装置①中导管g的作用__ ,装置③干燥管中碱石灰的作用除了吸收多余的氯气之外还有__ 的作用。
(3)尾气处理装置存在缺陷,请提出改进方案__ 。
(4)①装置反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,有同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法__ 。
A.将Cl-转化为AgCl沉淀,测定沉淀的质量
B.与足量锌反应,测量生成气体在标准状况下的体积
C.与足量NaHCO3反应,将得到的气体直接用碱石灰吸收,测定生成气体的质量
D.与足量NaHCO3反应,将得到的气体通入足量澄清石灰水,测定生成沉淀的质量

(1)①装置发生反应的离子方程式
(2)装置①中导管g的作用
(3)尾气处理装置存在缺陷,请提出改进方案
(4)①装置反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,有同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法
A.将Cl-转化为AgCl沉淀,测定沉淀的质量
B.与足量锌反应,测量生成气体在标准状况下的体积
C.与足量NaHCO3反应,将得到的气体直接用碱石灰吸收,测定生成气体的质量
D.与足量NaHCO3反应,将得到的气体通入足量澄清石灰水,测定生成沉淀的质量
您最近一年使用:0次
2020-12-27更新
|
244次组卷
|
2卷引用:浙江省台州市2019—2020学年高一上学期期末质量评估考试化学试题



