1 . 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,氧化剂是_______ ,还原剂是_______ ,被氧化与被还原的元素原子的物质的量之比为_______ 。
(2)写出该反应的化学方程式___ ,若反应中生成0.2molHNO3,转移的电子数目为____ 个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现,你判断该气体泄漏时的现象是_______ 。
(1)反应过程中,氧化剂是
(2)写出该反应的化学方程式
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现,你判断该气体泄漏时的现象是
您最近一年使用:0次
解题方法
2 . 利用含钒废催化剂(主要含有V2O5、VOSO4和SiO2)制备V2O5的新工艺流程如下:

已知:滤液 1和滤液 2 中钒以 VO2+的形式存在。回答下列问题:
(1)VO2+中钒元素的化合价是_______ 。
(2)工业上为了提高废催化剂的水浸率,除将废催化剂预先粉碎外,还可采取的措施有_______ 等(任写两种)。
(3)在“滤渣 1”中加入 Na2SO3和过量 H2SO4溶液发生了氧化还原反应,写出该反应的离子方程式:_______ 。滤渣 2 的主要成分是 _______ 。
(4)“混合液”中加入 KClO3,其目的是_______ 。
(5)常温下通过_______ (填“增大”或“减小”或“保持”)溶液的 pH值来实现由 VO 向 VO
向 VO 转变。
转变。
(6)由 NH4VO3制备 V2O5的化学方程式为_______ 。

已知:滤液 1和滤液 2 中钒以 VO2+的形式存在。回答下列问题:
(1)VO2+中钒元素的化合价是
(2)工业上为了提高废催化剂的水浸率,除将废催化剂预先粉碎外,还可采取的措施有
(3)在“滤渣 1”中加入 Na2SO3和过量 H2SO4溶液发生了氧化还原反应,写出该反应的离子方程式:
(4)“混合液”中加入 KClO3,其目的是
(5)常温下通过
 向 VO
向 VO 转变。
转变。(6)由 NH4VO3制备 V2O5的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
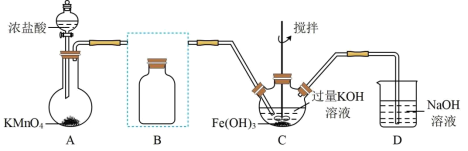
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
名校
4 . 某化学兴趣小组制取氯酸钾 和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。

(1)写出实验室制取 的化学方程式
的化学方程式_______ 。
(2)浓盐酸除了做还原剂还有_______ 作用。
(3) 与热的KOH溶液反应除了
与热的KOH溶液反应除了 和H2O外,还会生成
和H2O外,还会生成_______ (写化学式)。
(4)写出用NaOH溶液吸收尾气 的离子方程式
的离子方程式_______ 。
 和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
和氯水并进行有关探究实验。利用下图所示的实验装置进行实验。
(1)写出实验室制取
 的化学方程式
的化学方程式(2)浓盐酸除了做还原剂还有
(3)
 与热的KOH溶液反应除了
与热的KOH溶液反应除了 和H2O外,还会生成
和H2O外,还会生成(4)写出用NaOH溶液吸收尾气
 的离子方程式
的离子方程式
您最近一年使用:0次
22-23高三上·广东·阶段练习
解题方法
5 . 铈(Ce)是一种应用广泛的稀土元素,从氟碳铈矿(主要含CeFCO3、Fe2O3、SiO2)和天青石(主要含SrSO4、并含有少量Ba、Ca等杂质)伴生矿中回收铈,同时生产高纯碳酸锶(SrCO3)的一种生产工艺流程如图:
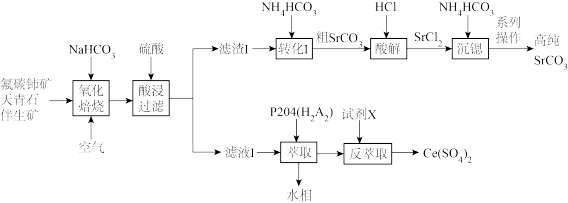
已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)① 中Ce的化合价为
中Ce的化合价为_______ ;
②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为_______ 。
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。
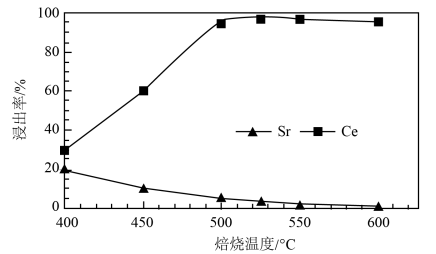
结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为_______ ,原因为_______ 。
(3)“沉锶”步骤中发生的离子反应方程式:_______ 。
(4)“萃取”步骤的原理为: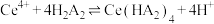 ,则试剂X为
,则试剂X为_______ 。

已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)①
 中Ce的化合价为
中Ce的化合价为②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。

结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为
(3)“沉锶”步骤中发生的离子反应方程式:
(4)“萃取”步骤的原理为:
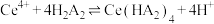 ,则试剂X为
,则试剂X为
您最近一年使用:0次
名校
6 . 氧化还原反应在物质制取和转化中有重要的应用。请回答下列问题:
(1) (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是_______ (填化学式,下同),还原剂是_______ 。
②该反应中被氧化的N原子与被还原的N原子的质量之比为_______ 。
③用单线桥标出该反应中电子的转移情况:_______ 。
(2)某反应体系有反应物和生成物共7种: 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: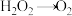 ,试回答下列问题:
,试回答下列问题:
①该反应中,发生还原反应的过程是_______ →_______ (填化学式)。
②写出该反应的化学方程式并配平:_______ 。
③若反应每消耗 ,生成
,生成_______  。
。
(1)
 (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是
②该反应中被氧化的N原子与被还原的N原子的质量之比为
③用单线桥标出该反应中电子的转移情况:
(2)某反应体系有反应物和生成物共7种:
 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: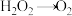 ,试回答下列问题:
,试回答下列问题:①该反应中,发生还原反应的过程是
②写出该反应的化学方程式并配平:
③若反应每消耗
 ,生成
,生成 。
。
您最近一年使用:0次
2022-11-19更新
|
130次组卷
|
2卷引用:山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
2022·湖北·模拟预测
名校
解题方法
7 . 金属铼(Re)广泛应用于国防、石油化工以及电子制造等领域,铼可通过还原高铼酸铵(NH4ReO4)制备。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图所示。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为_______ (回答任意两点)。
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为_______ 。
(3)“浸渣”的主要成分为_______
(4)“萃取”机理为:R3N+H++ReO =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为_______
(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为_______ 、过滤、洗涤、干燥。
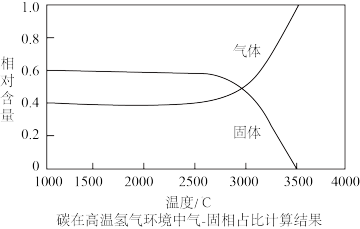
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为_______ 。
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因_______ 。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为
(3)“浸渣”的主要成分为
(4)“萃取”机理为:R3N+H++ReO
 =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因
| 物质 | 熔点(℃) | 沸点(℃) |
| Re | 3180 | 5900 |
| C | 3652 | 4827 |
| Fe | 1535 | 2750 |

您最近一年使用:0次
2022-11-18更新
|
535次组卷
|
4卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷湖北大学附属中学2023届高三上学期第二次联合测评化学试题湖北省高中名校联盟2022-2023学年高三上学期11月月考化学试题
8 . 二草酸合铜(Ⅱ)酸钾(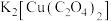 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
I.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至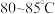 ,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
回答下列问题:
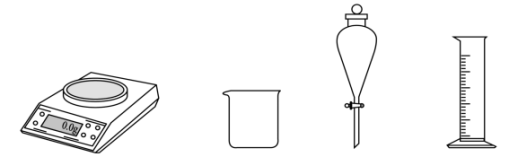
(1)由 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_______ (填仪器名称)。
实验室中配制 的
的 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为_______  。下列操作能导致所配制的
。下列操作能导致所配制的 溶液浓度偏大的是
溶液浓度偏大的是_______ 。
① 部分失水 ②容量瓶不干燥
部分失水 ②容量瓶不干燥
③未洗涤溶解固体所用的烧杯和玻璃棒 ④定容时俯视刻度线
(2)步骤I中过滤操作用到的玻璃仪器有_______ 。
(3)反应Ⅱ中原料配比为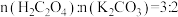 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(4)产品纯度分析:
准确称取合成的晶体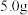 ,在氨水中溶解。试样完全溶解后转移至
,在氨水中溶解。试样完全溶解后转移至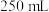 容量瓶中,加水至刻度线。取
容量瓶中,加水至刻度线。取 溶液用硫酸中和,并在硫酸溶液中用
溶液用硫酸中和,并在硫酸溶液中用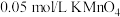 滴定试样中的
滴定试样中的 ,恰好完全反应时消耗的
,恰好完全反应时消耗的 溶液的体积为
溶液的体积为 。则产品中
。则产品中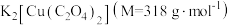 的纯度为
的纯度为_______  。(已知
。(已知 。产品中其它成分不与
。产品中其它成分不与 反应。)
反应。)
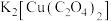 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:I.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至
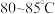 ,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。回答下列问题:
(1)由
 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
实验室中配制
 的
的 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为 。下列操作能导致所配制的
。下列操作能导致所配制的 溶液浓度偏大的是
溶液浓度偏大的是①
 部分失水 ②容量瓶不干燥
部分失水 ②容量瓶不干燥③未洗涤溶解固体所用的烧杯和玻璃棒 ④定容时俯视刻度线
(2)步骤I中过滤操作用到的玻璃仪器有
(3)反应Ⅱ中原料配比为
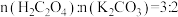 ,写出反应的化学方程式
,写出反应的化学方程式(4)产品纯度分析:
准确称取合成的晶体
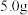 ,在氨水中溶解。试样完全溶解后转移至
,在氨水中溶解。试样完全溶解后转移至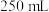 容量瓶中,加水至刻度线。取
容量瓶中,加水至刻度线。取 溶液用硫酸中和,并在硫酸溶液中用
溶液用硫酸中和,并在硫酸溶液中用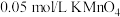 滴定试样中的
滴定试样中的 ,恰好完全反应时消耗的
,恰好完全反应时消耗的 溶液的体积为
溶液的体积为 。则产品中
。则产品中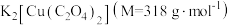 的纯度为
的纯度为 。(已知
。(已知 。产品中其它成分不与
。产品中其它成分不与 反应。)
反应。)
您最近一年使用:0次
解题方法
9 . 二氧化氯( )是一种新型高效安全消毒剂,易溶于水,沸点为
)是一种新型高效安全消毒剂,易溶于水,沸点为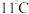 ,在空气中的体积分数超过
,在空气中的体积分数超过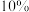 时有爆炸性。工业上利用硫铁矿[主要成分为二硫化亚铁(
时有爆炸性。工业上利用硫铁矿[主要成分为二硫化亚铁( )]还原氯酸钠(
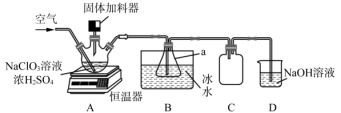
)]还原氯酸钠( )制取二氧化氯。某研究小组利用如图装置模拟工业制备
)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至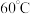 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
回答下列问题:
(1)仪器a的名称是_______ 。
(2)通入空气的目的为①_______ ,②_______ 。
(3)装置D中 溶液用于吸收多余的
溶液用于吸收多余的 。某兴趣小组在一定条件下将一定量的
。某兴趣小组在一定条件下将一定量的 通入
通入 溶液中,
溶液中, 恰好反应,得到的产物中含有
恰好反应,得到的产物中含有 、
、 和
和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为_______  。
。
(4)工业上可用 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中的
和盐酸,以除去水中的 。该反应的离子方程式为
。该反应的离子方程式为_______ 。若除去 的
的 ,反应消耗的
,反应消耗的 在标准状况下的体积为
在标准状况下的体积为_______  。
。
 )是一种新型高效安全消毒剂,易溶于水,沸点为
)是一种新型高效安全消毒剂,易溶于水,沸点为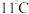 ,在空气中的体积分数超过
,在空气中的体积分数超过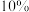 时有爆炸性。工业上利用硫铁矿[主要成分为二硫化亚铁(
时有爆炸性。工业上利用硫铁矿[主要成分为二硫化亚铁( )]还原氯酸钠(
)]还原氯酸钠( )制取二氧化氯。某研究小组利用如图装置模拟工业制备
)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至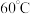 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
回答下列问题:
(1)仪器a的名称是
(2)通入空气的目的为①
(3)装置D中
 溶液用于吸收多余的
溶液用于吸收多余的 。某兴趣小组在一定条件下将一定量的
。某兴趣小组在一定条件下将一定量的 通入
通入 溶液中,
溶液中, 恰好反应,得到的产物中含有
恰好反应,得到的产物中含有 、
、 和
和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为 。
。(4)工业上可用
 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中的
和盐酸,以除去水中的 。该反应的离子方程式为
。该反应的离子方程式为 的
的 ,反应消耗的
,反应消耗的 在标准状况下的体积为
在标准状况下的体积为 。
。
您最近一年使用:0次
解题方法
10 . 钠是一种非常活泼、具有广泛应用的金属。
(1)金属钠通常保存在_______ 里,以隔绝空气。
(2)汽车安全气囊的气体发生剂 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
①当汽车发生较严重的碰撞时,引发 分解发生反应
分解发生反应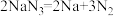 ,从而为气囊充气。产生的
,从而为气囊充气。产生的 立即与
立即与 发生置换反应生成
发生置换反应生成 ,化学方程式为
,化学方程式为_______ 。
② 是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为
是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为_______ 。
③一个安全气囊通常装有 ,其完全分解所释放的
,其完全分解所释放的 为
为_______  。
。
(3)工业上通过电解 生产金属钠:
生产金属钠: ,过程如下:
,过程如下:

已知:电解时需要将 加热至熔融状态。
加热至熔融状态。 的熔点为
的熔点为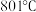 ,为降低能耗,通常加入
,为降低能耗,通常加入 把熔点降至约
把熔点降至约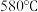 。
。
①把 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是_______ 。
②粗钠中含有少量杂质 ,过程Ⅱ除去
,过程Ⅱ除去 的化学方程式为
的化学方程式为_______ 。(不必写反应条件)
(1)金属钠通常保存在
(2)汽车安全气囊的气体发生剂
 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。①当汽车发生较严重的碰撞时,引发
 分解发生反应
分解发生反应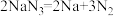 ,从而为气囊充气。产生的
,从而为气囊充气。产生的 立即与
立即与 发生置换反应生成
发生置换反应生成 ,化学方程式为
,化学方程式为②
 是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为
是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为③一个安全气囊通常装有
 ,其完全分解所释放的
,其完全分解所释放的 为
为 。
。(3)工业上通过电解
 生产金属钠:
生产金属钠: ,过程如下:
,过程如下:
已知:电解时需要将
 加热至熔融状态。
加热至熔融状态。 的熔点为
的熔点为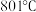 ,为降低能耗,通常加入
,为降低能耗,通常加入 把熔点降至约
把熔点降至约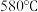 。
。①把
 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是②粗钠中含有少量杂质
 ,过程Ⅱ除去
,过程Ⅱ除去 的化学方程式为
的化学方程式为
您最近一年使用:0次



