21-22高三下·广东佛山·阶段练习
名校
解题方法
1 . 钪(Sc)是一种功能强大但产量稀少的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁(FeTiO3),还含有少量Sc2O3、MgO、SiO2等杂质,从钛铁矿中提取钪的流程如图:
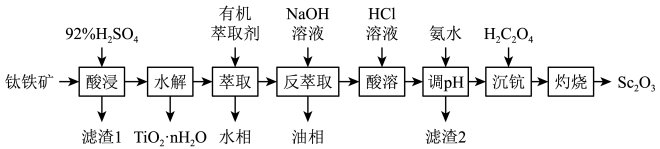
已知:
①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
②Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3
回答下列问题:
(1)“酸浸”后钛主要以TiOSO4的形式存在于溶液中,TiOSO4中Ti元素的化合价为_______ 。
(2)“滤渣1”的主要成分是________ 。
(3)氢氧化钪[Sc(OH)3]是白色固体,不溶于水,化学性质与Al(OH)3相似,能与NaOH溶液反应生成Na3[Sc(OH)6],写出该反应的离子方程式_________ 。
(4)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如下图,应选择最合适的O/A值为________ 。
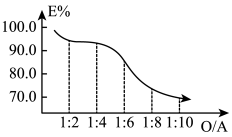
②温度对钪、钛的萃取率影响情况见上表,合适的萃取温度为10~15°C,其理由是_________ 。
(5)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、 Fe3+浓度均小于0.0lmol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是________ 。
(6)“沉钪”得到草酸钪[Sc(C2O4)3],将其置于_______ (填仪器名称)中,在空气中充分灼烧得到Sc2O3和一种无毒气体,请写出反应的化学方程式___________ 。

已知:
①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
②Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3
回答下列问题:
(1)“酸浸”后钛主要以TiOSO4的形式存在于溶液中,TiOSO4中Ti元素的化合价为
(2)“滤渣1”的主要成分是
(3)氢氧化钪[Sc(OH)3]是白色固体,不溶于水,化学性质与Al(OH)3相似,能与NaOH溶液反应生成Na3[Sc(OH)6],写出该反应的离子方程式
(4)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如下图,应选择最合适的O/A值为

| T/°C | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(5)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、 Fe3+浓度均小于0.0lmol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(6)“沉钪”得到草酸钪[Sc(C2O4)3],将其置于
您最近一年使用:0次
名校
解题方法
2 . 钌(Ru)是一种极其昂贵的稀有贵金属,广泛应用于电子、航空航天、石油化工、有机合成等领域。钌的矿产资源很少,因此从含钌废液中回收钌尤为重要。某含钌的废渣主要成分为Ru、 、
、 、
、 ,回收钌的工艺流程如下:
,回收钌的工艺流程如下:
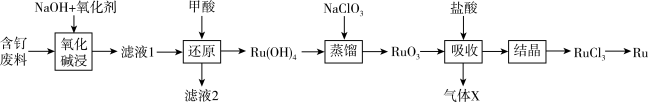
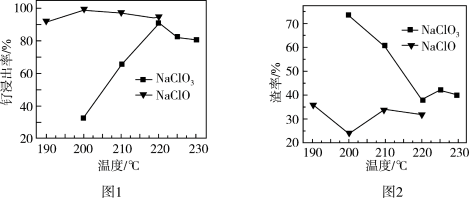
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
(2)滤液1中溶质的主要成分包括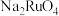 、
、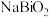 、
、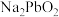 等,其中Si的存在形式为
等,其中Si的存在形式为_______ (填化学式); 转化为
转化为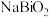 的化学方程式为
的化学方程式为_______ 。
(3)滤液1先用盐酸调节滤液pH,后用甲酸“还原”提取钌并同时生成 ,则该过程的离子方程式为
,则该过程的离子方程式为_______ ;“蒸馏”过程中氧化剂与还原剂的物质的量之比为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
(5)可用氢气还原重量法测定产品中 的纯度,所得实验数据记录如下:
的纯度,所得实验数据记录如下:
则产品的纯度为_______ (保留小数点后一位)。
 、
、 、
、 ,回收钌的工艺流程如下:
,回收钌的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为

(2)滤液1中溶质的主要成分包括
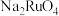 、
、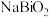 、
、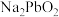 等,其中Si的存在形式为
等,其中Si的存在形式为 转化为
转化为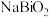 的化学方程式为
的化学方程式为(3)滤液1先用盐酸调节滤液pH,后用甲酸“还原”提取钌并同时生成
 ,则该过程的离子方程式为
,则该过程的离子方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢气还原重量法测定产品中
 的纯度,所得实验数据记录如下:
的纯度,所得实验数据记录如下:| 实验序号 | 产品的质量/g | 固体Ru的质量/g |
| ① | 2.4225 | 1.0110 |
| ② | 2.4225 | 1.0090 |
| ③ | 2.4225 | 1.0100 |
您最近一年使用:0次
2022-08-03更新
|
919次组卷
|
4卷引用:山东省历城第二中学等学校2023届高三上学期10月月考联合考试化学试题
山东省历城第二中学等学校2023届高三上学期10月月考联合考试化学试题 青海省海东市第一中学2022届高三第二次模拟考试理科综合化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)山东省泰安新泰市第一中学(实验部)2023-2024学年高三上学期第一次质量检测化学试题
3 . 硫酸是重要的化工产品之一,以黄铁矿(主要成分FeS2)为原料生产硫酸的一种流程如图所示。
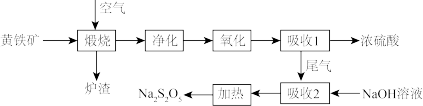
回答下列问题:
(1)黄铁矿预先粉碎的目的是____ 。已知炉渣的主要成分是Fe2O3,则煅烧的化学方程式为_____ 。
(2)某化工厂生产硫酸,使用一种含杂质为25%的黄铁矿为原料。若取2吨该矿石,可制得98%的浓硫酸____ 吨(假设生产过程中硫的损失为零)。
(3)Na2S2O5是一种食品抗氧化剂,检验Na2S2O5已被氧化的实验方案是____ 。
(4)某同学以如图所示装置用电化学原理模拟生产硫酸:
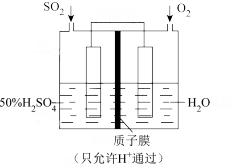
①写出通入O2的电极的电极反应式____ 。
②若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左-△m右)为____ g(忽略气体的溶解)。

回答下列问题:
(1)黄铁矿预先粉碎的目的是
(2)某化工厂生产硫酸,使用一种含杂质为25%的黄铁矿为原料。若取2吨该矿石,可制得98%的浓硫酸
(3)Na2S2O5是一种食品抗氧化剂,检验Na2S2O5已被氧化的实验方案是
(4)某同学以如图所示装置用电化学原理模拟生产硫酸:
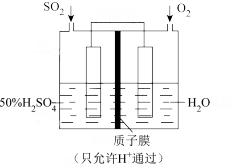
①写出通入O2的电极的电极反应式
②若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左-△m右)为
您最近一年使用:0次
2022-07-24更新
|
493次组卷
|
2卷引用:山东省济南市2021-2022学年高一下学期期末考试化学试题
名校
4 . 某班同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______ 。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______ 。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为:_______ 。
(5)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=0.2mol/L,c(Fe3+)=0.01mol/L,c(Cl-)=0.63 mol/L,则该溶液的c(H+)=_______ 。
②完成NaClO3氧化酸性FeCl2的离子方程式:________
_______ClO +_______Fe2++_______ =_______Fe3++_______Cl-+ _______
+_______Fe2++_______ =_______Fe3++_______Cl-+ _______
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为:
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为:
(5)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2废液中:c(Fe2+)=0.2mol/L,c(Fe3+)=0.01mol/L,c(Cl-)=0.63 mol/L,则该溶液的c(H+)=
②完成NaClO3氧化酸性FeCl2的离子方程式:
_______ClO
 +_______Fe2++_______ =_______Fe3++_______Cl-+ _______
+_______Fe2++_______ =_______Fe3++_______Cl-+ _______
您最近一年使用:0次
2022-07-21更新
|
465次组卷
|
2卷引用:山东省济南市历城第二中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 利用工业钒铬废液(主要成分为NaVO3和Na2CrO4)制备NH4VO3和Na2CrO4晶体的流程如下:
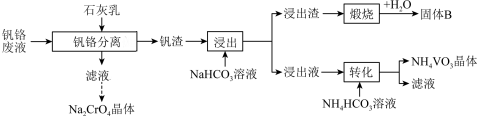
已知:I.“钒渣”的主要成分为Ca3(VO4)2;NH4VO3在pH=7~8时溶解度最小。
Ⅱ.随pH的变化,含铬微粒的变化存在2CrO +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。
回答下列问题:
(1)“钒铬分离”时,为了提高石灰乳的利用率,可采取的措施是___________ 。
(2)获取Na2CrO4晶体后,含铬废水需经过“酸化→还原→沉降”方可排放。“还原”使用Na2S2O4溶液,所得还原产物为Cr3+,反应的离子方程式为___________ ;为了使c(Cr3+)不高于1.0×10-5mol·L-1,“沉降”时应调节pH至少___________ [该温度下Cr(OH)3的Ksp约为1.0×10-29.6]。
(3)“浸出”时反应的离子方程式为___________ ;“转化”中析出NH4VO3晶体时,需加入过量NH4HCO3,原因是___________ ;选用NH4HCO3溶液不选用NH4C1溶液的原因是___________
(4)该流程中可循环利用的物质有___________ 。

已知:I.“钒渣”的主要成分为Ca3(VO4)2;NH4VO3在pH=7~8时溶解度最小。
Ⅱ.随pH的变化,含铬微粒的变化存在2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。回答下列问题:
(1)“钒铬分离”时,为了提高石灰乳的利用率,可采取的措施是
(2)获取Na2CrO4晶体后,含铬废水需经过“酸化→还原→沉降”方可排放。“还原”使用Na2S2O4溶液,所得还原产物为Cr3+,反应的离子方程式为
(3)“浸出”时反应的离子方程式为
(4)该流程中可循环利用的物质有
您最近一年使用:0次
2022-06-24更新
|
698次组卷
|
2卷引用:山东省实验中学2022届高三打靶化学试题
名校
解题方法
6 .  具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备 的一种流程:
的一种流程:

已知: 饱和溶液在低于
饱和溶液在低于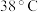 时析出
时析出 ,高于
,高于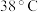 时析出
时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ ,若生成 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中, 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”)。
(3)由 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到 产品。
产品。
 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。下列是制备 的一种流程:
的一种流程:
已知:
 饱和溶液在低于
饱和溶液在低于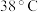 时析出
时析出 ,高于
,高于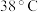 时析出
时析出 。
。(1)写出“合成”中发生反应的离子方程式:
 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中,
 的作用是
的作用是(3)由
 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩, 产品。
产品。
您最近一年使用:0次
名校
7 . 钴的化合物种类较多,其中三氯化六氨合(III){[Co(NH3)6]C13}(M=267.5g/mol),在工业上用途广泛。实验室以活性炭作为催化剂,以H2O2作氧化剂氧化CoC12的方法制备三氯化六氨合钴。
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是_______ 。
(2)按照气体流向从左到右连接仪器的顺序为_______ →_______ →_______ 。
(3)B装置的烧瓶中发生反应的离子方程式为_______ 。
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待_______ (填现象)时,再加热A装置,目的是_______ 。
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为_______ 。
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→_______ (按顺序填序号),纯度为_______ (写出表达式)。
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为 )
)
已知:①钴单质在300℃以上易被氧气氧化,CoC12易潮解。②Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
I.CoC12的制备。

(1)B装置中盛放浓盐酸的仪器名称是
(2)按照气体流向从左到右连接仪器的顺序为
(3)B装置的烧瓶中发生反应的离子方程式为
(4)实验时,要先加入浓盐酸,使B装置中开始生成氯气,待
II.三氯化六氨合钴(III)的制备。

①先向三颈烧瓶中加入活性炭、CoCl2和NH4Cl溶液,然后滴加稍过量的浓氨水;
②冷水浴冷却至10℃以下,缓慢滴加H2O2溶液并不断搅拌;
③转移至60℃水浴中,恒温加热同时缓慢搅拌;
④冷却结晶,过滤洗涤可得三氯化六氨合钴(III){[Co(NH3)6]Cl3)粗产品。
(5)D装置中制备三氯化六氨合钴(III)的总反应化学方程式为
III.纯度测定。
(6)称取mg粗产品与氢氧化钠在空气中混合煅烧得氧化钴→将氧化钴用稀硫酸溶解→配成250mL溶液→
a.向锥形瓶中加入稍过量的KI溶液(Co3+被还原后的产物为Co2+),充分反应
b.平行滴定三次,消耗标准溶液的体积平均值为VmL
c.取25.00mL待测液于锥形瓶中
d.用淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定(产物为
 )
)
您最近一年使用:0次
2022-06-02更新
|
985次组卷
|
4卷引用:山东师范大学附属中学2022届高三考前预测化学试题
名校
解题方法
8 . 碘及其化合物广泛用于医药、染料等方面。一种制备方法如图所示,下列有关说法正确的是:


| A.整个流程中涉及的化学反应类型均为氧化还原反应 |
B.过量 会将 会将 氧化为 氧化为 ,其反应的离子方程式为: ,其反应的离子方程式为: |
C.通入 后,若氧化产物只有一种,反应的化学方程式为: 后,若氧化产物只有一种,反应的化学方程式为: |
| D.转化中生成的沉淀与硝酸反应的产物可循环使用 |
您最近一年使用:0次
9 . 玻璃仪器内壁残留的硫单质可用热NaOH溶液洗涤除去,发生如下反应:
①3S+ 6NaOH 2Na2S+ Na2SO3+ 3H2O
2Na2S+ Na2SO3+ 3H2O
②(x-1)S+Na2S Na2Sx (x=2~6)
Na2Sx (x=2~6)
③S+ Na2SO3 Na2S2O3
Na2S2O3
下列说法正确的是
①3S+ 6NaOH
 2Na2S+ Na2SO3+ 3H2O
2Na2S+ Na2SO3+ 3H2O②(x-1)S+Na2S
 Na2Sx (x=2~6)
Na2Sx (x=2~6)③S+ Na2SO3
 Na2S2O3
Na2S2O3下列说法正确的是
| A.反应①②③中,硫单质的作用相同 |
| B.反应①中,每消耗1 mol硫单质转移4 mol电子 |
| C.0.96g硫单质与amL2mol·L-1热NaOH溶液恰好完全反应,只生成Na2S和Na2SO3,则a= 60 |
| D.1.28 g硫单质与10 mL 2 mol·L-1热NaOH溶液恰好完全反应,只生成Na2Sx和Na2S2O3,则x=5 |
您最近一年使用:0次
2022-05-21更新
|
1614次组卷
|
9卷引用:山东省济南市2022届高三下学期5月模拟考试(三模)化学试题
山东省济南市2022届高三下学期5月模拟考试(三模)化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题山东省济宁市育才中学2022-2023学年高三10月线上阶段性检测化学试题山东省济宁市第一中学2022-2023学年高三上学期第一次月考化学试题福建省厦门双十中学2022-2023学年高三上学期期中考试化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省济宁市第一中学2024届高三下学期4月份定时检测化学试题
名校
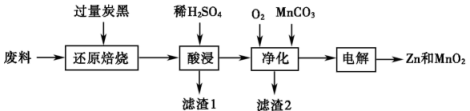
10 . 将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如下:(已知:
的一种工艺流程如下:(已知: 的金属活动性强于
的金属活动性强于 ,
, 在酸性条件下比较稳定,
在酸性条件下比较稳定, 大于5.5时易被氧化)
大于5.5时易被氧化)
下列说法错误的是
 、
、 、
、 及
及 等,用该废料制备
等,用该废料制备 和
和 的一种工艺流程如下:(已知:
的一种工艺流程如下:(已知: 的金属活动性强于
的金属活动性强于 ,
, 在酸性条件下比较稳定,
在酸性条件下比较稳定, 大于5.5时易被氧化)
大于5.5时易被氧化)
下列说法错误的是
A.“还原焙烧”时 元素被还原,有气体产物生成 元素被还原,有气体产物生成 |
| B.滤渣1、滤渣2的主要成分分别为炭黑、氢氧化铁 |
C.“净化”时通入的 可用 可用 来代替, 来代替, 的作用是调节溶液的 的作用是调节溶液的 大于5.5以便于除去杂质离子 大于5.5以便于除去杂质离子 |
D.“电解”时的阳极反应式为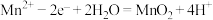 |
您最近一年使用:0次
2022-05-05更新
|
444次组卷
|
2卷引用:山东省济南市历城第二中学2022-2023学年高三上学期期末考试化学试题



