名校
1 . 高铁酸钠(Na2FeO4)具有强氧化性,是一种新型高效水处理剂。高铁酸钠投入水中发生反应:Na2FeO4+ H2O→Fe(OH)3(胶体)+NaOH+O2↑(未配平)。下列有关说法正确的是( )
| A.氧气的氧化性强于高铁酸钠 |
| B.Fe(OH)3(胶体)在水处理过程中能起到杀菌消毒作用 |
| C.该反应中O2是氧化产物,NaOH既不是氧化产物也不是还原产物 |
| D.1mol高铁酸钠的消毒能力(依据反应中转移电子数计)相当于3mol氯气 |
您最近一年使用:0次
2019-11-22更新
|
140次组卷
|
2卷引用:山东省平度市第九中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
2 . 利用如图可以从不同角度研究含铁物质的性质及其转化关系。图中甲~己均含铁元素。回答下列问题:

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有____ 性;下列关于乙的说法正确的是______ (填标号)。
a.属于酸性氧化物,能与碱反应
b.属于碱性氧化物,能与酸反应
c.属于两性氧化物,既能与酸反应,又能与碱反应
(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为____ 。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______ ,现象为______ 。

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有
a.属于酸性氧化物,能与碱反应
b.属于碱性氧化物,能与酸反应
c.属于两性氧化物,既能与酸反应,又能与碱反应
(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为
您最近一年使用:0次
2019-10-23更新
|
454次组卷
|
7卷引用:山东省青岛平度市2019-2020学年高一下学期线上阶段测试化学试题
山东省青岛平度市2019-2020学年高一下学期线上阶段测试化学试题2019-2020学年新新教材同步人教版高中化学必修第一册 (模块)质量检测(已下线)3.1.2 铁及其化合物之间的转化关系练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)河北省张家口宣化一中2020-2021学年高一下学期3月月考化学试题山东省2018年夏季普通高中学业水平合格考试化学试题河北省石家庄市行唐启明中学2022-2023学年高一上学期期末考试化学试题(已下线)专题九 铁及其化合物
名校
3 . 元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:

已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________ 。
(2)高镍矿破碎细磨的作用______________________________________ 。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________ 。
(4)造渣除铁时发生的化学反应方程式___________________________________ (产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________ 。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaClO溶液,滴加过程中发生反应的离子方程式为_________________________________________________________ 。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________ ,阳极泥的成分为________________ (写名称)。

已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为
(2)高镍矿破碎细磨的作用
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是
(4)造渣除铁时发生的化学反应方程式
(5)电解制粗镍时阳极发生的主要电极反应式
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaClO溶液,滴加过程中发生反应的离子方程式为
(7)电解精炼镍的过程需控制pH为2~5,试分析原因
您最近一年使用:0次
2019-05-13更新
|
842次组卷
|
5卷引用:山东省青岛市莱西第一中学2020届高三下学期质量检测化学试题
山东省青岛市莱西第一中学2020届高三下学期质量检测化学试题山东省青岛市平度市2020届高三3月高考模拟化学试卷【校级联考】山东省实验中学、淄博实验中学、烟台一中、莱芜一中四校2019届高三下学期第一次联合模拟考试理科综合化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)(已下线)03 无机化工流程题(3) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
4 . 下列关于氮及其化合物的说法错误 的是
| A.N2化学性质稳定,可用作保护气 |
| B.NO、NO2均为大气污染气体,在大气中可稳定存在 |
| C.可用浓盐酸检测输送NH3的管道是否发生泄漏 |
| D.HNO3具有强氧化性,可溶解铜、银等不活泼金属 |
您最近一年使用:0次
2019-05-04更新
|
408次组卷
|
9卷引用:山东省青岛平度市2019-2020学年高一下学期线上阶段测试化学试题
山东省青岛平度市2019-2020学年高一下学期线上阶段测试化学试题【校级联考】广东省深圳四校发展联盟体2018-2019学年高一第二学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——硝酸强化练习江苏省淮阴中学2019-2020学年高一下学期期末考试化学试题河北省张家口宣化一中2020-2021学年高一下学期3月月考化学试题云南省玉溪市一中2020-2021学年高一下学期期中考试化学(文)试题山东省2018年夏季普通高中学业水平合格考试化学试题广东省清远市博爱学校2021-2022学年高一下学期第一次教学质量检测化学试题山东省聊城市江北水城旅游度假区某校2023-2024学年高一下学期第一次自主学习成果汇报化学试题
5 . ClO2 又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如下图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。

已知:①高氯酸:沸点90℃,浓度低于60%比较稳定,浓度高 60%遇含碳化合物易爆炸。
②回答下列问题:
(1)仪器a的名称为_________________________ 。实验开始前,胶塞及导管接口必须包锡箔纸,其原因是_________ 。
(2)写出装置A制备ClO2同时生成高氯酸的化学方程式__________________________________ 。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间,装置C中生成NaClO2,离子方程式为____________ 。若关闭止水夹③,打开止水夹②,B中可观察到的现象为______________________ 。
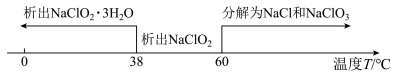
(4)从装置C反应后的溶液中获得NaClO2晶体,需控温在_______________ 范围内进行减压蒸发结晶,采用减压蒸发的原因是___________________________________________ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,NaClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是____________ 。

已知:①高氯酸:沸点90℃,浓度低于60%比较稳定,浓度高 60%遇含碳化合物易爆炸。

②回答下列问题:
(1)仪器a的名称为
(2)写出装置A制备ClO2同时生成高氯酸的化学方程式
(3)关闭止水夹②,打开止水夹①③,通空气一段时间,装置C中生成NaClO2,离子方程式为
(4)从装置C反应后的溶液中获得NaClO2晶体,需控温在
(5)城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,NaClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是
您最近一年使用:0次
真题
名校
6 . 硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____ ,原料中的金属钠通常保存在____ 中,实验室取用少量金属钠需要用到的实验用品有_____ ,_____ ,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2=□NaBH4+□Na2SiO3______________
(3)第②步分离采用的方法是______ ;第③步分离(NaBH4)并回收溶剂,采用的方法是______ 。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8克NaBH4(s)放热21.6kJ,该反应的热化学方程式是_______ 。

已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是
(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2=□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8克NaBH4(s)放热21.6kJ,该反应的热化学方程式是
您最近一年使用:0次
2019-01-30更新
|
1909次组卷
|
3卷引用:2016届山东省青岛市胶州一中高三上学期11月模拟化学试卷
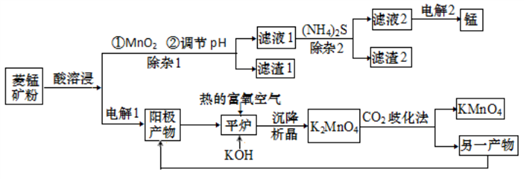
7 . 锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
已知 25 ℃时,部分物质的溶度积常数如下:
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________ (任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________ ;滤渣2 的主要成分是____________________________ 。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______ 。
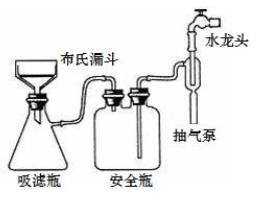
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________ 。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________ 。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________ 。

已知 25 ℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是

a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式
您最近一年使用:0次
2018-03-21更新
|
398次组卷
|
3卷引用:山东省青岛市2018年高三第一次模拟考试理综化学试题
名校
解题方法
8 . NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:___ NaNO2+___ HI ═___ NO↑+___ I2 +___ NaI +___ H2O.
(1)配平上述化学方程式_______________ 。
(2)上述反应中氧化剂是____________ ;若有1mol 的还原剂被氧化,则反应中转移电子的数目是_____________
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl.,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:_____________ (填字母).
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用.NH4Cl ,能使NaNO2转化为不引起二次污染的N2,反应的离子方程式为:______________________ 。
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+_______ ____________________________________________________________ .若反应过程中转移5mol e-,则生成标准状况下N2的体积为_____________ L.
(1)配平上述化学方程式
(2)上述反应中氧化剂是
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl.,可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋。进行试验,下列选项合适的是:
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用.NH4Cl ,能使NaNO2转化为不引起二次污染的N2,反应的离子方程式为:
(5)请配平以下化学方程式:Al+NaNO3+NaOH=NaAlO2+N2↑+
您最近一年使用:0次
2017-10-21更新
|
300次组卷
|
2卷引用:山东省青岛第二中学2022-2023学年高一上学期期末考试化学试题
9 . 下面是工业上以含金、银、铂、铜的金属废料提取金、银、铂的工艺流程。
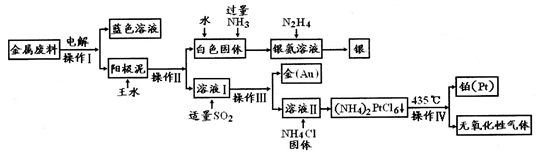
已知:溶液I中铂和金形成化合物为H[AuC14]和H2[PtCl6]。浓盐酸物质浓度:12mol/L,密度1.179g/cm3;浓硝酸质量分数约为65%,密度约为1.4g/cm3
(1)写出NH4C1的电子式______________ 。
(2)操作I中金属废料应该连接电源的____ 极,若另一极采用纯铜,该过程的工业名称为________________ 。
(3)依据信息和所学知识,王水配制的具体操作为_________________ 。
(4)通入SO2的作用是__________ ,SO2不能通入过量的原因是_____________ 。
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式______________ 。
(6)由银制备银-氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2g气体时,甲池溶液质量变化为_________________ 。

已知:溶液I中铂和金形成化合物为H[AuC14]和H2[PtCl6]。浓盐酸物质浓度:12mol/L,密度1.179g/cm3;浓硝酸质量分数约为65%,密度约为1.4g/cm3
(1)写出NH4C1的电子式
(2)操作I中金属废料应该连接电源的
(3)依据信息和所学知识,王水配制的具体操作为
(4)通入SO2的作用是
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式
(6)由银制备银-氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2g气体时,甲池溶液质量变化为
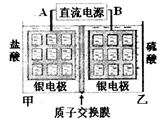
您最近一年使用:0次
名校
10 . 某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):

①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答下列问题:
(1)步骤②中鼓入热空气的作用为_____________________________ 。
(2)步骤③中发生的主要反应的离子方程式为______________________________ 。
(3)此实验中尾气可用______ (填字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________ 。
(5)与B装置相比,采用C装置的优点为____________ 。

①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答下列问题:
(1)步骤②中鼓入热空气的作用为
(2)步骤③中发生的主要反应的离子方程式为
(3)此实验中尾气可用
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为
(5)与B装置相比,采用C装置的优点为
您最近一年使用:0次
2017-05-05更新
|
474次组卷
|
4卷引用:山东省青岛第二中学2022-2023学年高一上学期期末考试化学试题
山东省青岛第二中学2022-2023学年高一上学期期末考试化学试题广西桂林市桂林中学2016-2017学年高一下学期期中考试化学试题河北省定州中学2016-2017学年高一(承智班)下学期期末考试化学试题(已下线)2018年5月27日 每周一测——《每日一题》2017-2018学年高一化学人教必修2



