名校
解题方法
1 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟 氧化结合
氧化结合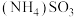 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。
①已知: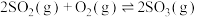
 ,则
,则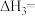
_______ 。
②其他条件不变时,高于150℃,在相同时间内 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是_______ 。
③其他条件不变, 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因_______ 。 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:_______ 。
② 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是_______ 。
③在吸收器中, 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是_______ 。
④在吸收器中,随着吸收过程的进行,部分 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是_______ 。
 氧化结合
氧化结合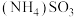 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。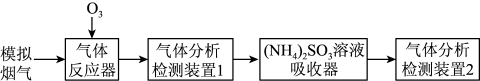
| 反应 | 平衡常数(25℃) | 活化能/(kJ/mol) |
反应a: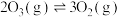 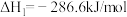 |  | 24.6 |
反应b: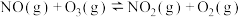 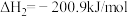 | 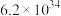 | 3.17 |
反应c:  | 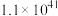 | 58.17 |
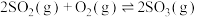
 ,则
,则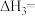
②其他条件不变时,高于150℃,在相同时间内
 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是③其他条件不变,
 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因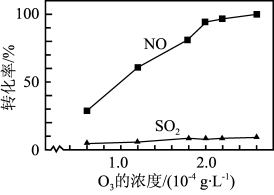
 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。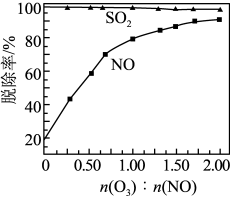
 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:②
 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是③在吸收器中,
 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是④在吸收器中,随着吸收过程的进行,部分
 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是
您最近一年使用:0次
2022-04-10更新
|
763次组卷
|
6卷引用:湖南省株洲市第四中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
2 . 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:

| A.“焙烧I”时,加入少量CaO可提高矿粉中硫的去除率 |
B.用NaOH溶液吸收过量SO2的离子方程式为: 2OH- +SO2=SO +H2O +H2O |
| C.滤液中通入足量CO2,过滤后可得到Al2O3 |
| D.无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:16 |
您最近一年使用:0次
2022-04-09更新
|
1198次组卷
|
11卷引用:湖南省株洲市第二中学2022届高三下学期期中考试化学试题
湖南省株洲市第二中学2022届高三下学期期中考试化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项05 氧化还原反应-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)山东省潍坊市2022届高三下学期5月模拟考试(一)化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题进阶训练7(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(不定项选择题)(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆和田地区第二中学2022-2023学年高一上学期11月期中考试化学试题(已下线)单项选择题1-5
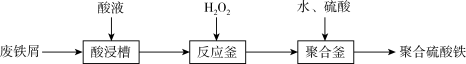
3 . 聚合硫酸铁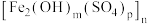 是一种新型絮凝剂,其处理污水能力比
是一种新型絮凝剂,其处理污水能力比 强,且腐蚀性小。工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。下列说法正确的是
强,且腐蚀性小。工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。下列说法正确的是
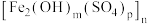 是一种新型絮凝剂,其处理污水能力比
是一种新型絮凝剂,其处理污水能力比 强,且腐蚀性小。工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。下列说法正确的是
强,且腐蚀性小。工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。下列说法正确的是
A.聚合硫酸铁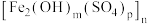 中 中 |
| B.酸浸槽中加入的酸液可用稀硝酸 |
C.反应釜中发生的离子反应为 |
| D.聚合釜中控制溶液的pH越大越好 |
您最近一年使用:0次
2022-03-25更新
|
260次组卷
|
8卷引用:湖南省株洲市第二中学2023届高三第七次月考化学试题
湖南省株洲市第二中学2023届高三第七次月考化学试题(已下线)2022年河北省新高考测评卷(八)(已下线)卷04 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)2022年河北省高考真题变式题(1-9)湖南省衡阳市第八中学2023届高三第五次月考化学试题湖南省涟源市第一中学2023届高三第五次月考化学试题湖南省永州市第一中学2022-2023学年高三第七次月考化学试题湖南省娄底市新化县第一中学2023届高三第七次月考化学试题
4 . K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)已知K3[Fe(C2O4)3]•3H2O中Fe为+3价,则C的化合价为____ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
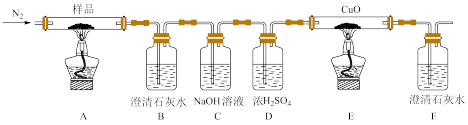
①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、____ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3。
(3)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,加入适量cmol·L-1KMnO4溶液充分反应,至恰好反应完全,此过程发生的反应是:____ 。
____ +____
+____  +____→____CO2↑+____Mn2++____(请完成配平)。
+____→____CO2↑+____Mn2++____(请完成配平)。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为____ 。
(1)已知K3[Fe(C2O4)3]•3H2O中Fe为+3价,则C的化合价为
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3。
(3)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,加入适量cmol·L-1KMnO4溶液充分反应,至恰好反应完全,此过程发生的反应是:
____
 +____
+____  +____→____CO2↑+____Mn2++____(请完成配平)。
+____→____CO2↑+____Mn2++____(请完成配平)。②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
2022-03-22更新
|
418次组卷
|
3卷引用:湖南省株洲市第二中学2021-2022学年高一上学期第三次月考化学试题
5 . 铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
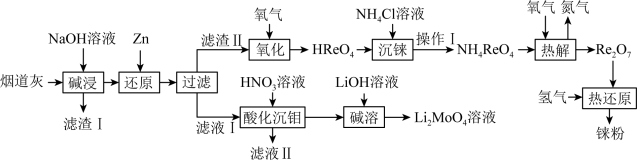
已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应_______ (填写化学方程式)、MoO3+2NaOH=NaMoO4+H2O,则“滤渣I”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成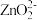 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___________ 。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___________ 、___________ 、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为___________ 。
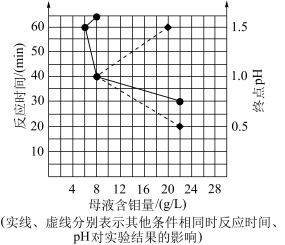
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为___________ min、pH为___________ 。
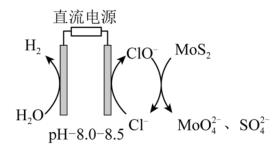
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为______ g。

已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应
(2)“还原”时,Zn被氧化成
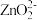 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括
(4)“热解”时,发生反应的化学方程式为
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为

(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为

您最近一年使用:0次
2022-03-08更新
|
857次组卷
|
6卷引用:湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题
湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第二次月考化学试题(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题湖南省衡阳市第八中学2021-2022学年高三下学期开学考试(第六次月考)化学试题广东名校2021-2022学年高三下学期开学测试化学试题湖南省永州市第四中学2022届高三下学期期中考试化学试题
名校
6 . 某研究性学习小组利用氯型阴离子交换树脂(RCl)从海带中提取 ,并测定反应
,并测定反应 的平衡常数。
的平衡常数。
Ⅰ.离子交换法提取 的流程如下:
的流程如下:

已知:①交换吸附发生反应: ,
, ;
;
②吸附 和
和 达饱和的树脂分别呈淡黄色和黑红色。
达饱和的树脂分别呈淡黄色和黑红色。
(1)“氧化”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(2)“一次洗脱”已经完成的现象是___________ 。
(3)洗脱液1中,碘元素以___________ (填离子符号)存在,向其中加入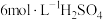 ,可析出碘晶体。
,可析出碘晶体。
(4)将分离出碘晶体的洗脱液合并,置于___________ (填仪器名称)中,加入乙醚,振荡,静置,分液。后经___________ (填操作名称)回收乙醚。
Ⅱ.测定反应 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用 溶液进行滴定,测定
溶液进行滴定,测定 和
和 的总浓度。
的总浓度。

(5)不能用普通锥形瓶代替碘量瓶的原因___________ 。
(6)0.5g的碘的不需要精确称取的理由是___________ 。
(7)碘量瓶①平衡体系中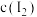 与②中
与②中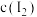 接近。
接近。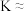
___________ (保留3位有效数字)。
 ,并测定反应
,并测定反应 的平衡常数。
的平衡常数。Ⅰ.离子交换法提取
 的流程如下:
的流程如下:
已知:①交换吸附发生反应:
 ,
, ;
;②吸附
 和
和 达饱和的树脂分别呈淡黄色和黑红色。
达饱和的树脂分别呈淡黄色和黑红色。(1)“氧化”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(2)“一次洗脱”已经完成的现象是
(3)洗脱液1中,碘元素以
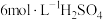 ,可析出碘晶体。
,可析出碘晶体。(4)将分离出碘晶体的洗脱液合并,置于
Ⅱ.测定反应
 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用
 溶液进行滴定,测定
溶液进行滴定,测定 和
和 的总浓度。
的总浓度。
| 编号 | 250mL碘量瓶① | 250mL碘量瓶② |
| 药品 | 0.5g研细的碘 | 0.5g研细的碘 |
 和 和 的总浓度 的总浓度 |  |  |
(6)0.5g的碘的不需要精确称取的理由是
(7)碘量瓶①平衡体系中
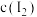 与②中
与②中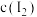 接近。
接近。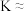
您最近一年使用:0次
2022-03-06更新
|
1020次组卷
|
6卷引用:湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题
湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题福建省泉州市2022届高中毕业班质量检测(三)化学试题福建省泉州市2022届高三下学期3月质量监测(三)化学试题吉林省东北师范大学附属中学2021-2022 学年高三下学期测试(七)理科综合化学试题(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
7 . 以黄铁矿(主要成分是FeS2,含少量SiO2)和软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3)为原料制备MnSO4·H2O的工艺流程如下。下列说法错误的是
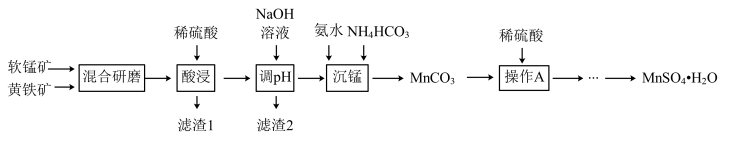

A.酸浸过程得到的滤液中含有Mn2+、Fe3+,则该过程中主要反应的离子方程式是 |
| B.滤渣1的成分中含有S和SiO2 |
| C.酸浸和沉锰操作均应在较高温度下进行 |
| D.调pH的目的是除去Fe3+、Al3+ |
您最近一年使用:0次
2022-03-06更新
|
621次组卷
|
3卷引用:湖南省株洲市第一中学2023届高三第七次月考化学试题
名校
8 . 铝硅铁合金(AlxFeySiz)是炼钢过程中重要的脱氧剂。为测定其化学式,设计了如下流程,根据流程回答下列问题:
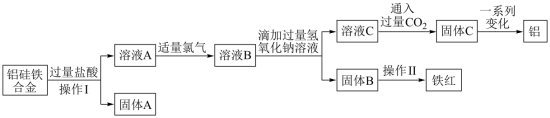
(1)操作Ⅰ的名称是_______ 。
(2)固体A可用于生产半导体材料,固体A为_______ 。
(3)通入氯气的作用是_______ ,此时发生反应的离子方程式为_______ 。
(4)向溶液B中滴加氢氧化钠溶液的过程中产生沉淀的物质的量与加入氢氧化钠溶液的体积关系正确的是_______。(填正确答案标号)。
(5)生成固体C的同时还生成NaHCO3,该反应离子方程式为_______ 。
(6)实验测定固体A的质量为560g,铝的质量为810g,铁红的质量为80g,则铝硅铁合金的化学式为_______ ,该流程中铝硅铁合金与过量盐酸反应,在标准状况下产生的气体的体积V=_______ L。

(1)操作Ⅰ的名称是
(2)固体A可用于生产半导体材料,固体A为
(3)通入氯气的作用是
(4)向溶液B中滴加氢氧化钠溶液的过程中产生沉淀的物质的量与加入氢氧化钠溶液的体积关系正确的是_______。(填正确答案标号)。
A. | B.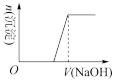 | C.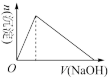 | D. |
(6)实验测定固体A的质量为560g,铝的质量为810g,铁红的质量为80g,则铝硅铁合金的化学式为
您最近一年使用:0次
2022-03-05更新
|
153次组卷
|
2卷引用:湖南省株洲市第八中学2022-2023学年高三上学期第二次月考化学试题
9 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2298次组卷
|
14卷引用:湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题
湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
10 . 我国稀土储量世界第一,稀土元素铈是当代高科技新材料的重要组成部分。以稀土精矿(主要成分为CeFCO3、CePO4,还有SiO2、Al2O3)为原料制备Ce2(CO3)3·nH2O(n>3)及CeCl3的工艺流程如下:
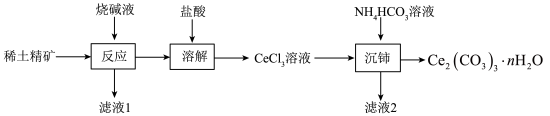
回答下列问题:
(1)稀土精矿在分解槽中与烧碱液在140℃时反应,Ce元素均转化为Ce(OH)3,其中CeFCO3发生反应的化学方程式为___________ 。
(2)“反应”不能在陶瓷容器中进行的原因是___________ 。
(3)“沉铈”过程中反应的离子方程式为___________ 。判断Ce3+已经完全沉淀的实验操作是___________ 。
(4)常温下,若Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1时溶液的pH为5,则溶液中c( )=
)=___________ mol·L-1(保留2位小数)。已知常温下Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11,Ksp[Ce2(CO3)3]=1.0×10-28
(5)工业沉铈过程中常选用NH4HCO3溶液作沉淀剂,若用Na2CO3代替NH4HCO3可能产生其他固体杂质,该杂质为___________ 。
(6)CeCl3溶液还可经过一系列操作得到CeCl3·6H2O,将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中NH4Cl固体的作用是___________ 。

回答下列问题:
(1)稀土精矿在分解槽中与烧碱液在140℃时反应,Ce元素均转化为Ce(OH)3,其中CeFCO3发生反应的化学方程式为
(2)“反应”不能在陶瓷容器中进行的原因是
(3)“沉铈”过程中反应的离子方程式为
(4)常温下,若Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1时溶液的pH为5,则溶液中c(
 )=
)=(5)工业沉铈过程中常选用NH4HCO3溶液作沉淀剂,若用Na2CO3代替NH4HCO3可能产生其他固体杂质,该杂质为
(6)CeCl3溶液还可经过一系列操作得到CeCl3·6H2O,将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中NH4Cl固体的作用是
您最近一年使用:0次
2022-02-17更新
|
309次组卷
|
3卷引用:湖南省株洲市第二中学2021届高三下学期第三次模拟考试化学试卷



