1 . 氮族元素包括氮、磷、砷、锑、铋等几种元素,请根据所掌握知识,回答以下问题。
(1)古代农谚中有“雷雨发庄稼”、“豆茬种谷,必定有福”,其中雷雨、豆茬涉及到的是自然固氮,请再写一种人工固氮方法的名称___________ 。
(2)N2是最稳定的双原子分子,原因是___________ 。
(3)联氨(N2H4)可由NH3与NaClO溶液反应制得,请写出相应的离子反应方程式___________ 。已知联氨与一水合氨类似,是一种二元弱碱向联氨溶液中加入过量硫酸生成的酸式盐的化学式为___________ 。
(4)标准状况下,将体积为VL的试管中充满NO2,倒置于水槽中,同时立即向其中通入O2,充分反应后,试管中剩余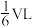 的气体,则通入的O2体积为
的气体,则通入的O2体积为___________ (保留3位小数)。
(5)常见的磷酸有:正磷酸H3PO4,亚磷酸H3PO3,次磷酸H3PO2,偏磷酸HPO3,焦磷酸H4P2O7等,其中亚磷酸和次磷酸都有强还原性,请写出次磷酸与AgNO3溶液反应的离子方程式___________ 。
(6)铜与足量浓硝酸反应后,溶液会呈现出绿色,经过科学探究证明是溶解了NO2所致,现有反应后的绿色溶液,请设计一个简单实验,证明上述科学探究结论___________ (写出操作 和现象 )。
(1)古代农谚中有“雷雨发庄稼”、“豆茬种谷,必定有福”,其中雷雨、豆茬涉及到的是自然固氮,请再写一种人工固氮方法的名称
(2)N2是最稳定的双原子分子,原因是
(3)联氨(N2H4)可由NH3与NaClO溶液反应制得,请写出相应的离子反应方程式
(4)标准状况下,将体积为VL的试管中充满NO2,倒置于水槽中,同时立即向其中通入O2,充分反应后,试管中剩余
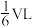 的气体,则通入的O2体积为
的气体,则通入的O2体积为(5)常见的磷酸有:正磷酸H3PO4,亚磷酸H3PO3,次磷酸H3PO2,偏磷酸HPO3,焦磷酸H4P2O7等,其中亚磷酸和次磷酸都有强还原性,请写出次磷酸与AgNO3溶液反应的离子方程式
(6)铜与足量浓硝酸反应后,溶液会呈现出绿色,经过科学探究证明是溶解了NO2所致,现有反应后的绿色溶液,请设计一个简单实验,证明上述科学探究结论
您最近一年使用:0次
2021-11-02更新
|
393次组卷
|
3卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题
湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题河南省信阳市2021-2022学年高三上学期第一次教学质量检测化学试题(已下线)微专题29 非金属及其化合物制备流程与实验探究(Si、N、P、As)-备战2023年高考化学一轮复习考点微专题
名校
解题方法
2 . 次氯酸(HClO)消毒液高效安全,适用于一般物体表面消毒、手部消毒,以及地面、空间和环境消毒。下图装置在D中制得颜色类似于氯气的Cl2O气体,E中得到次氯酸(HClO)。已知Cl2O气体45℃可分解,与水反应生成HClO。

(1)A装置圆底烧瓶中固体物质是___________ 。
(2)C装置、F装置中分别盛装___________ 、___________ 。
(3)实验时,一直要通入干燥的空气,其体积大约是氯气的3倍,主要作用是___________ ,同时还可以抑制Cl2O的分解,保证实验安全。
(4)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。
①如果用Na2CO3·xH2O表示含水碳酸钠,则x为___________ 。
②D中生成的气体中含有CO2,则生成Cl2O的化学方程式为___________ 。
(5)次氯酸含量分析:取E装置中试管内黄绿色溶液两等分,一份是通过与足量KI溶液反应生成n(I2),来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgCl)计算氯元素含量。实验结果是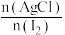 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液 为
为___________ 。

(1)A装置圆底烧瓶中固体物质是
(2)C装置、F装置中分别盛装
(3)实验时,一直要通入干燥的空气,其体积大约是氯气的3倍,主要作用是
(4)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。
①如果用Na2CO3·xH2O表示含水碳酸钠,则x为
②D中生成的气体中含有CO2,则生成Cl2O的化学方程式为
(5)次氯酸含量分析:取E装置中试管内黄绿色溶液两等分,一份是通过与足量KI溶液反应生成n(I2),来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgCl)计算氯元素含量。实验结果是
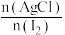 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液 为
为
您最近一年使用:0次
2021-10-24更新
|
232次组卷
|
3卷引用:湖南省攸县第一中学2023届高三第七次月考化学试题
3 . 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平): +Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是
+Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是
 +Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是
+Fe2++H+=Mn2++Fe3++H2O;下列说法不正确的是A. 是氧化剂,Fe3+是氧化产物 是氧化剂,Fe3+是氧化产物 |
| B.Mn2+的还原性弱于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1分子水时,转移2.5个电子 |
您最近一年使用:0次
2021-10-22更新
|
621次组卷
|
4卷引用:湖南省株洲市第二中学2023-2024学年高一上学期第一次适应性检测化学试题
名校
解题方法
4 . 氟碳铈矿(主要成分为 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1) 中
中 的化合价为
的化合价为___________ 。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________ (用化学方程式解释)。
(3) 是一种难溶于水的有机溶剂,则操作Ⅰ的名称为
是一种难溶于水的有机溶剂,则操作Ⅰ的名称为____________________ 。
(4)氧化焙烧后的产物之一为 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为____________________ 。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________ 。
(6)有机物 能将
能将 从水溶液中提取出来,该过程可表示为:
从水溶液中提取出来,该过程可表示为: 。向
。向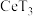 (有机层)中加入稀硫酸能获得较纯的含
(有机层)中加入稀硫酸能获得较纯的含 水溶液,从平衡角度解释其原因:
水溶液,从平衡角度解释其原因:____________________ 。
(7)写出向 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式:
的化学方程式:____________________ 。
 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)氧化培烧时不能使用陶瓷容器,原因是
(3)
 是一种难溶于水的有机溶剂,则操作Ⅰ的名称为
是一种难溶于水的有机溶剂,则操作Ⅰ的名称为(4)氧化焙烧后的产物之一为
 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(6)有机物
 能将
能将 从水溶液中提取出来,该过程可表示为:
从水溶液中提取出来,该过程可表示为: 。向
。向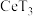 (有机层)中加入稀硫酸能获得较纯的含
(有机层)中加入稀硫酸能获得较纯的含 水溶液,从平衡角度解释其原因:
水溶液,从平衡角度解释其原因:(7)写出向
 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式:
的化学方程式:
您最近一年使用:0次
2021-10-21更新
|
126次组卷
|
6卷引用:湖南省株洲市第一中学2022-2023学年高三上学期第一次月考化学试题
湖南省株洲市第一中学2022-2023学年高三上学期第一次月考化学试题湖北省华师一附中、黄冈中学等八校2020届高三第一次(12月)联考理综化学试题(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编黑龙江省双鸭山市第一中学2021届高三上学期第一次月考化学试题陕西省商洛市洛南中学2022届高三第二次模拟考试化学试题湖北省仙桃市沔城高级中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
5 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效,二氧化锗( )可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分
)可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分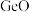 、
、 、
、 、
、 ,及少量
,及少量 等难溶物杂质)进行处理的流程如图:
等难溶物杂质)进行处理的流程如图:

已知: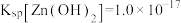 ,
, ,请回答下列问题:
,请回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为_______ 。
(2)“酸溶”时,请写出两条提高酸溶速率的措施:_______ 。
(3)常温下,“调 ”时,滤液1中的所有金属离子恰好都沉淀完全时的
”时,滤液1中的所有金属离子恰好都沉淀完全时的 为
为_______ 。
(4)“氧化吸收”时,发生反应的离子方程式为_______ 。该过程中温度不宜太高的原因是_______ 。
(5)“水解”为四氯化锗与高纯水反应,其化学方程式为_______ ,为了让该反应趋于完全,制备时需_______ 。
(6)电解高纯 和
和 的混合物,可制得硅锗合金。反应原理如下:
的混合物,可制得硅锗合金。反应原理如下: ,生成硅锗合金的电极为
,生成硅锗合金的电极为_______ (填“阳极”或“阴极”)。写出生成 的电极反应式:
的电极反应式:_______ 。
 )可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分
)可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分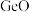 、
、 、
、 、
、 ,及少量
,及少量 等难溶物杂质)进行处理的流程如图:
等难溶物杂质)进行处理的流程如图:
已知:
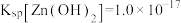 ,
, ,请回答下列问题:
,请回答下列问题:(1)
 的离子结构示意图为
的离子结构示意图为(2)“酸溶”时,请写出两条提高酸溶速率的措施:
(3)常温下,“调
 ”时,滤液1中的所有金属离子恰好都沉淀完全时的
”时,滤液1中的所有金属离子恰好都沉淀完全时的 为
为(4)“氧化吸收”时,发生反应的离子方程式为
(5)“水解”为四氯化锗与高纯水反应,其化学方程式为
(6)电解高纯
 和
和 的混合物,可制得硅锗合金。反应原理如下:
的混合物,可制得硅锗合金。反应原理如下: ,生成硅锗合金的电极为
,生成硅锗合金的电极为 的电极反应式:
的电极反应式:
您最近一年使用:0次
2021-09-28更新
|
402次组卷
|
4卷引用:湖南省株洲市攸县第三中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
6 . 工业上利用软锰矿(主要成分为MnO2,还含Fe、Al、Mg、Zn、Ca、Si等元素)与纤维素制备Mn3O4,工艺如下图所示。

(1)利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、耗能低,还具有的优点是___________ (回答两点)。
(2)“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:___________
____C6H12O6+____MnO2+____=____Mn2++____CO2↑+____
(3)“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:
“中和”步骤要调节溶液pH,最适宜的pH范围是___________ 。
(4)“净化”时,加入Na2S、NH4F是为了将Zn2+、Mg2+转化为ZnS和MgF2沉淀除去,还能除去___________ (填元素符号)。
(5)“沉锰”时,主要生成Mn2(OH)2SO4和Mn(OH)2沉淀,其中生成Mn(OH)2的离子方程式为___________ 。
(6)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为___________ min;下列说法错误的是___________ 。

A.前15min,主要发生的反应是6Mn(OH)2+O2=2Mn3O4+6H2O,pH下降较慢
B.15~150min,主要发生的反应是3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO ,pH下降较快
,pH下降较快
C.150min之后,pH趋于稳定,则Mn2(OH)2SO4已完全氧化
D.250min后,继续通入空气,可能将产品氧化生成Mn2O3及MnO2,使产品中的锰含量下降

(1)利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、耗能低,还具有的优点是
(2)“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:
____C6H12O6+____MnO2+____=____Mn2++____CO2↑+____
(3)“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Zn2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.0 | 8.9 | 6.0 | 8.1 |
| 完全沉淀的pH | 2.8 | 4.7 | 10.9 | 8.0 | 10.1 |
(4)“净化”时,加入Na2S、NH4F是为了将Zn2+、Mg2+转化为ZnS和MgF2沉淀除去,还能除去
(5)“沉锰”时,主要生成Mn2(OH)2SO4和Mn(OH)2沉淀,其中生成Mn(OH)2的离子方程式为
(6)“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为

A.前15min,主要发生的反应是6Mn(OH)2+O2=2Mn3O4+6H2O,pH下降较慢
B.15~150min,主要发生的反应是3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO
 ,pH下降较快
,pH下降较快C.150min之后,pH趋于稳定,则Mn2(OH)2SO4已完全氧化
D.250min后,继续通入空气,可能将产品氧化生成Mn2O3及MnO2,使产品中的锰含量下降
您最近一年使用:0次
7 . 如图是某化学反应的微观示意图。下列有关说法正确的是


| A.该反应是复分解反应 |
B.反应方程式为NH3+O2 H2O+N2 H2O+N2 |
| C.生成物丙、丁的质量比为9:14 |
| D.反应前后只有一种元素的化合价不变 |
您最近一年使用:0次
2021-08-31更新
|
198次组卷
|
6卷引用:湖南省株洲市第二中学2023-2024学年高一上学期第二次适应性检测化学试题
名校
解题方法
8 . K2FeO4具有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4,其制备的流程如下:

K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”有FeO 生成。下列有关说法正确的是
生成。下列有关说法正确的是

K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”有FeO
 生成。下列有关说法正确的是
生成。下列有关说法正确的是| A.K2FeO4中铁元素的化合价是+3 |
B.“转化1”发生反应的离子方程式为:2Fe3++3ClO—+5H2O=2 +3Cl—+10H+ +3Cl—+10H+ |
| C.“转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小 |
| D.过滤所得产品可用冷水洗去表面杂质离子 |
您最近一年使用:0次
2021-07-31更新
|
525次组卷
|
5卷引用:湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
名校
9 . 氢化钙( )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ.固体 的部分性质:常温:
的部分性质:常温: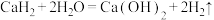
Ⅱ.金属 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:
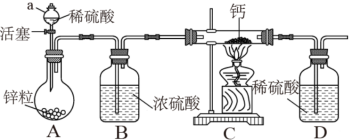
(1)写出 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式___________ 。
(2)仪器a的名称___________ ;组装好仪器后,先进行的操作是___________ 。
(3)D中浓硫酸的作用为___________ 。
(4)实验时,先___________ (填“打开A中活塞”或“点燃C中酒精灯”),目的是___________ 。
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是___________ 。
该小组同学通过反思提出问题:如何检验制得的 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
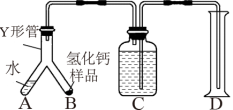
步骤1:检查装置气密性,装入足量的水和质量为mg的 样品,按图连接仪器。
样品,按图连接仪器。
步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V 。
。
(6)当
___________  时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为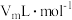 )
)
 )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。【查阅资料】
Ⅰ.固体
 的部分性质:常温:
的部分性质:常温: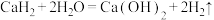
Ⅱ.金属
 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:

(1)写出
 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式(2)仪器a的名称
(3)D中浓硫酸的作用为
(4)实验时,先
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有
 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是该小组同学通过反思提出问题:如何检验制得的
 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
步骤1:检查装置气密性,装入足量的水和质量为mg的
 样品,按图连接仪器。
样品,按图连接仪器。步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V
 。
。(6)当

 时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为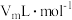 )
)
您最近一年使用:0次
2021-07-07更新
|
1070次组卷
|
4卷引用:湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
10 . 硫铁矿的主要成分为 ,工业上常用硫铁矿在空气中煅烧产气来制备硫酸,该过程中的烧渣可用于制备铁红、绿矾等。现以硫铁矿烧渣(主要成分为
,工业上常用硫铁矿在空气中煅烧产气来制备硫酸,该过程中的烧渣可用于制备铁红、绿矾等。现以硫铁矿烧渣(主要成分为 、FeO,还含有少量的
、FeO,还含有少量的 、
、 杂质)为原料、氨水为沉淀剂制备铁红颜料的流程如图所示:
杂质)为原料、氨水为沉淀剂制备铁红颜料的流程如图所示:

根据所学知识,回答下列问题:
(1)写出 高温煅烧生成
高温煅烧生成 的化学方程式:
的化学方程式:___________ ,其中氧化产物为___________ (填化学式)。
(2)“浸取液Ⅰ”中加入 的目的是
的目的是___________ ,发生反应的离子方程式为___________ 。
(3)“操作Ⅰ”的名称为___________ 。
(4)在加入氨水沉淀时,调节pH可使得 沉淀而
沉淀而 不沉淀。“滤液Ⅱ”中溶质的主要成分为
不沉淀。“滤液Ⅱ”中溶质的主要成分为___________ (填化学式)。写出获得“滤渣Ⅱ”的离子方程式:___________ 。
 ,工业上常用硫铁矿在空气中煅烧产气来制备硫酸,该过程中的烧渣可用于制备铁红、绿矾等。现以硫铁矿烧渣(主要成分为
,工业上常用硫铁矿在空气中煅烧产气来制备硫酸,该过程中的烧渣可用于制备铁红、绿矾等。现以硫铁矿烧渣(主要成分为 、FeO,还含有少量的
、FeO,还含有少量的 、
、 杂质)为原料、氨水为沉淀剂制备铁红颜料的流程如图所示:
杂质)为原料、氨水为沉淀剂制备铁红颜料的流程如图所示:
根据所学知识,回答下列问题:
(1)写出
 高温煅烧生成
高温煅烧生成 的化学方程式:
的化学方程式:(2)“浸取液Ⅰ”中加入
 的目的是
的目的是(3)“操作Ⅰ”的名称为
(4)在加入氨水沉淀时,调节pH可使得
 沉淀而
沉淀而 不沉淀。“滤液Ⅱ”中溶质的主要成分为
不沉淀。“滤液Ⅱ”中溶质的主要成分为
您最近一年使用:0次
2021-07-04更新
|
941次组卷
|
9卷引用:湖南省株洲市南方中学2023届高三上学期第一次月考化学试题
湖南省株洲市南方中学2023届高三上学期第一次月考化学试题山西省临汾市2020-2021学年高一下学期期末考试化学试题广东省部分名校2020-2021学年下学期高一期末联考化学试题(已下线)微专题31 化学工艺流程题——原料的预处理-备战2022年高考化学考点微专题吉林省吉林市第二中学2022届高三上学期9月月考化学试题(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)四川省江油中学2021-2022学年高二上学期入学考试理综化学试题山西省运城市稷山县稷山中学2021-2022学年高一下学期期中测试化学试题重庆市三峡名校联盟2022-2023学年高一下学期春季联考化学试题



