名校
1 . 市政污泥含大量金属(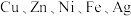 等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(
等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:
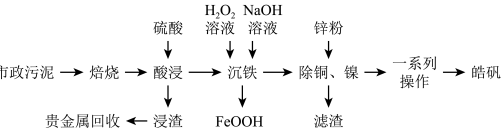
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有___________ (任写一条)。
(2)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤、干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为___________ 。
(4)“浸渣”中含有 ,经一系列处理得
,经一系列处理得 {可溶于水,电离成
{可溶于水,电离成 和
和 },用肼(N2H4),还原
},用肼(N2H4),还原 得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:___________ ,则反应中氧化剂与还原剂的物质的量之比为___________ 。
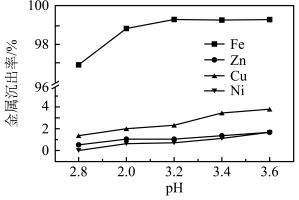
(5)浸出液中含有 ,“沉铁”步骤中发生反应的离子方程式为
,“沉铁”步骤中发生反应的离子方程式为___________ 。pH对不同金属沉出率的影响如图所示,在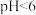 时,
时,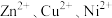 在溶液中以离子形式存在,但是有铁离子存在时,pH升高,
在溶液中以离子形式存在,但是有铁离子存在时,pH升高, 损失率均升高,原因可能是
损失率均升高,原因可能是___________ 。
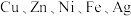 等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(
等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为(4)“浸渣”中含有
 ,经一系列处理得
,经一系列处理得 {可溶于水,电离成
{可溶于水,电离成 和
和 },用肼(N2H4),还原
},用肼(N2H4),还原 得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:(5)浸出液中含有
 ,“沉铁”步骤中发生反应的离子方程式为
,“沉铁”步骤中发生反应的离子方程式为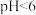 时,
时,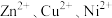 在溶液中以离子形式存在,但是有铁离子存在时,pH升高,
在溶液中以离子形式存在,但是有铁离子存在时,pH升高, 损失率均升高,原因可能是
损失率均升高,原因可能是
您最近一年使用:0次
2022-01-19更新
|
144次组卷
|
2卷引用:湖南省株洲市醴陵市第一中学2021-2022学年高三下学期期中考试化学试题
2 . 含氯消毒剂可有效灭活新冠病毒,为新冠疫情防控做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。二氧化氯(ClO2)是黄绿色易溶于水的气体,熔点-59°C,沸点11°C,但其浓度过高时易分解爆炸,故常采用H2O2和NaOH混合溶液将其吸收转化为NaClO2固体便于运输和贮存。现利用如下装置及试剂制备。
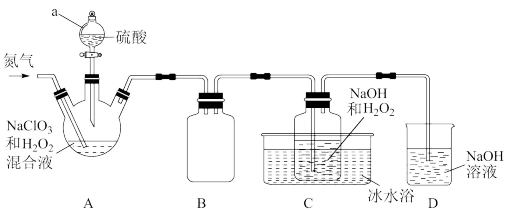
请回答下列问题:
(1)仪器a的名称为___________ ,装置A中反应的化学方程式为___________ 。
(2)通入氮气的主要作用___________ 、___________ 。
(3)装置B的作用是___________ 。装置D的作用是___________ 。
(4)一段时间后,C装置中有NaClO2晶体析出,则C装置中发生的离子反应方程式为___________ ,冰水浴冷却的目的是___________ 。
(5)测定NaClO2样品的纯度:取C中NaClO2晶体5.0g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL。(已知:I2+2 =
= +2I-)
+2I-)
①滴定终点的现象:___________ 。
②试计算NaClO2样品的纯度___________ 。

请回答下列问题:
(1)仪器a的名称为
(2)通入氮气的主要作用
(3)装置B的作用是
(4)一段时间后,C装置中有NaClO2晶体析出,则C装置中发生的离子反应方程式为
(5)测定NaClO2样品的纯度:取C中NaClO2晶体5.0g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL。(已知:I2+2
 =
= +2I-)
+2I-)①滴定终点的现象:
②试计算NaClO2样品的纯度
您最近一年使用:0次
2021-12-31更新
|
408次组卷
|
4卷引用:湖南省株洲市攸县第一中学2022-2023学年高三上学期第三次月考化学试题
名校
3 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是84消毒液,可以说化学让生活更美好。下图为84消毒液说明书。请回答下列问题。
(1)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25g·L-1计算,该消毒液的NaClO的物质的量浓度是___________ 。
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:___________ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___________ ,从氧化还原角度分析Cl2表现了___________ 性。
(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)___________ (已知酸性:H2CO3>HClO>HCO )。
)。
(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会___________ (填“增强”或“减弱”)。
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g·L-1~60.00g·L-1 | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1∶200水溶液 餐饮具、瓜果等1∶100水溶液 |
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)
 )。
)。(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
2021-12-21更新
|
183次组卷
|
2卷引用:湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
名校
解题方法
4 . 五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂。N2O5常温下为白色固体,可溶于CH2Cl2等氯代经溶剂,微溶于水且与水反应生成强酸,高于室温时对热不稳定。
(1)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:

回答下列问题:
①装置C的名称__ ,装置E的作用是__ 。
②写出装置A中发生反应的化学方程式__ 。
③实验时,将装置C浸入__ (填“热水”或“冰水”)中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。关闭分液漏斗的活塞,打开活塞K,通过臭氧发生器向装置C中通入含有臭氧的氧气。
(2)判断C中反应已结束的简单方法是__ 。
(3)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0g粗产品,加入20.00mL0.1250mol·L-1酸性高锰酸钾溶液。充分反应后,用0.1000mol·L-1H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为__ 。
②判断滴定终点的方法是__ 。
③产品中N2O4的质量分数为__ 。
(1)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:

回答下列问题:
①装置C的名称
②写出装置A中发生反应的化学方程式
③实验时,将装置C浸入
(2)判断C中反应已结束的简单方法是
(3)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0g粗产品,加入20.00mL0.1250mol·L-1酸性高锰酸钾溶液。充分反应后,用0.1000mol·L-1H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为
②判断滴定终点的方法是
③产品中N2O4的质量分数为
您最近一年使用:0次
2021-12-19更新
|
736次组卷
|
7卷引用:湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题
湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题陕西省汉中市2021-2022学年高三上学期教学质量第一次检测考试化学试题山东省滨州市2021-2022学年高三上学期第一次检测化学试题(已下线)专题36 物质的制备及实验方案的设计与评价(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题湖南师范大学附属中学2021-2022学年高三下学期第六次月考化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
名校
解题方法
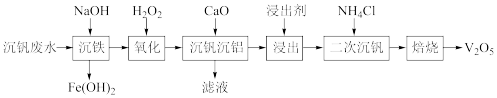
5 . 钒广泛应用于钢铁工业,钒的氧化物在化学工业常用作催化剂。某沉钒废水(含Al3+、Fe2+、VO2+)钒含量约为2%。从该沉钒废水中分离出铁元素并制备V2O5的流程如下所示:
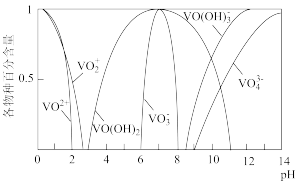
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式___________ 。
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是___________ 。
(3)写出“氧化'‘时发生的离子方程式___________ 。
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是___________ 。

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是___________ 。
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式___________ 。

已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。

②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是
(3)写出“氧化'‘时发生的离子方程式
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式
您最近一年使用:0次
2021-12-14更新
|
1091次组卷
|
6卷引用:湖南省株洲市醴陵市第一中学2023届高三第四次月考化学试题
名校
6 . 滴定是分析化学中重要的分析方法之一,根据其原理回答下列问题:
Ⅰ.酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25 mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00 mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为___________ (填“大于”“小于”或“等于”)15.00 mL。
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作:___________ 。
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中 的质量分数。
的质量分数。
实验步骤:称取6 g粗品配制250 mL溶液待用。用酸式滴定管取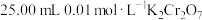 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液25.00 mL。回答下列问题:
溶液25.00 mL。回答下列问题:
(3)向 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(4) 溶液滴定至终点的现象为
溶液滴定至终点的现象为___________ 。
(5)粗品中 的质量分数为
的质量分数为___________ 。
(6)若在取 溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
溶液时有部分溶液滴到了锥形瓶外,则测定结果偏___________ (填“高”“低”或“不变”)。
Ⅰ.酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25 mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00 mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作:
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中
 的质量分数。
的质量分数。实验步骤:称取6 g粗品配制250 mL溶液待用。用酸式滴定管取
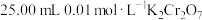 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液25.00 mL。回答下列问题:
溶液25.00 mL。回答下列问题:(3)向
 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)
 溶液滴定至终点的现象为
溶液滴定至终点的现象为(5)粗品中
 的质量分数为
的质量分数为(6)若在取
 溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
您最近一年使用:0次
2021-12-07更新
|
274次组卷
|
3卷引用:湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . 按要求回答下列问题:
(1)3S+6KOH K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为_______ 。
(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有_______ 。
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
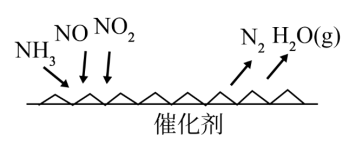
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:
①该反应的还原剂为_______ 。
②写出烟气中NO2与足量氨气反应的化学方程式_______ 。
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:
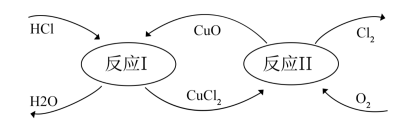
反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为_______ 。
(1)3S+6KOH
 K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:

①该反应的还原剂为
②写出烟气中NO2与足量氨气反应的化学方程式
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:

反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为
您最近一年使用:0次
2021-11-30更新
|
172次组卷
|
2卷引用:湖南省株洲市攸县第三中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
8 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:

已知电解总反应为:2ClO2+2NaCl 2NaClO2+Cl2
2NaClO2+Cl2
回答下列问题:
(1)NaClO2中Cl的化合价为___________ 。
(2)从物质分类角度来看NaHSO4是___________ (填字母)。
a.酸 b.酸式盐 c.电解质 d.非电解质 e.离子化合物(由离子构成) f.共价化合物(由分子构成)
(3)写出“反应”步骤中生成ClO2的化学方程式___________ 。
(4)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为___________ 、___________ 。
(5)“尾气吸收”是吸收“电解”过程排出的少量ClO2,吸收反应中,氧化剂(ClO2)与还原剂(H2O2)的物质的量之比为___________ 。

已知电解总反应为:2ClO2+2NaCl
 2NaClO2+Cl2
2NaClO2+Cl2回答下列问题:
(1)NaClO2中Cl的化合价为
(2)从物质分类角度来看NaHSO4是
a.酸 b.酸式盐 c.电解质 d.非电解质 e.离子化合物(由离子构成) f.共价化合物(由分子构成)
(3)写出“反应”步骤中生成ClO2的化学方程式
(4)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为
(5)“尾气吸收”是吸收“电解”过程排出的少量ClO2,吸收反应中,氧化剂(ClO2)与还原剂(H2O2)的物质的量之比为
您最近一年使用:0次
2021-11-19更新
|
485次组卷
|
2卷引用:湖南省株洲市攸县第一中学2022-2023学年高一上学期期中考试化学试题
名校
9 . 利用烟气中SO2可回收废水中的 ,实现碘单质的再生,其反应原理如下图所示
,实现碘单质的再生,其反应原理如下图所示
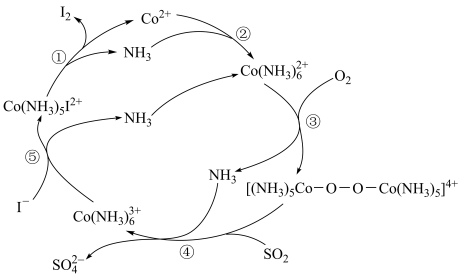
下列说法错误的是
 ,实现碘单质的再生,其反应原理如下图所示
,实现碘单质的再生,其反应原理如下图所示
下列说法错误的是
A. 中Co的化合价为+3价 中Co的化合价为+3价 |
B.总反应离子方程式为: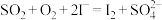 |
| C.反应①~⑤中均有电子的转移 |
| D.反应③中,每消耗1molO2会转移2mol电子 |
您最近一年使用:0次
2021-11-17更新
|
1139次组卷
|
17卷引用:湖南省株洲市攸县一中2022-2023学年高三第四次月考化学试题
湖南省株洲市攸县一中2022-2023学年高三第四次月考化学试题河南省重点中学2021-2022学年高三上学期模拟调研(一)化学试题 江西省宜春市上高二中2021-2022学年高三上学期第四次月考理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)安徽师范大学附属中学2021-2022学年高三上学期第五次综合测试理综化学试题河南省商城县观庙高级中学2021-2022学年高三上学期12月月考化学试题(已下线)一轮巩固卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题江苏省南京市六校联合体2021-2022学年高二下学期期末联考化学试题江苏省泰州中学2022-2023学年高三上学期期初调研考试 化学试题湖北省宜城市第三高级中学2021-2022学年高三上学期期中考试化学试题陕西省渭南市华州区咸林中学2022-2023学年高三上学期第二阶段考试化学试题江苏省扬州市江都区邵伯高级中学2022-2023学年高三10月阶段性测试化学试题福建省厦门第一中学2022-2023学年高一下学期期中考试化学试题福建省厦门第二中学2022-2023 学年高一下学期 5 月阶段性考试化学试题甘肃省张掖市民乐县第一中学2023-2024学年高三上学期第二次诊断(期中)考试化学试题
名校
10 . 碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(1)设计“操作Ⅰ”的主要步骤:___ 。
(2)“试剂a”通常应具有一定的___ 性。利用H2O2完成“溶液A”向“溶液B”的转变,配平该反应的化学方程式:___ 。
______KI+______H2O2=______KOH+______I2
(3)为寻找H2O2的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替H2O2(简要说明所用的试剂、现象和结论)___ 。
(4)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ (选填编号)。
(5)“操作Ⅱ”宜选用的装置是___ (选填编号)。
(6)为回收“有机溶液X”中的溶剂,并得到碘单质,可选用如图装置完成“操作Ⅲ”。
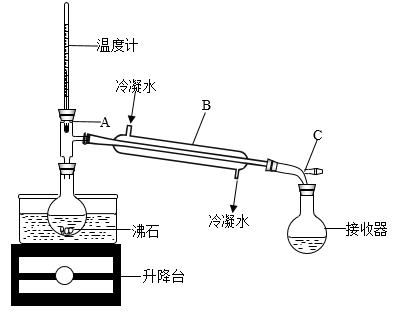
①装置B的名称是:___ 。
②装置A中,温度计所处的正确位置是___ (选填编号)。
a.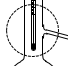 b.
b.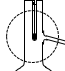 c.
c.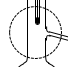
③指出该装置中一处明显的错误___ 。

(1)设计“操作Ⅰ”的主要步骤:
(2)“试剂a”通常应具有一定的
______KI+______H2O2=______KOH+______I2
(3)为寻找H2O2的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替H2O2(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
A. | B. | C. | D. |

①装置B的名称是:
②装置A中,温度计所处的正确位置是
a.
 b.
b. c.
c.
③指出该装置中一处明显的错误
您最近一年使用:0次
2021-11-17更新
|
693次组卷
|
2卷引用:湖南省株洲市九方中学2022-2023学年高三上学期第三次月考化学试题



