名校
解题方法
1 . 锰在冶金工业、电子工业等方面有广泛应用。某软锰矿的主要成分为MnO2、SiO2、CaO和少量的MgO、CuO,一种利用废铁屑还原浸出该软锰矿并制取金属锰的工艺流程如下:
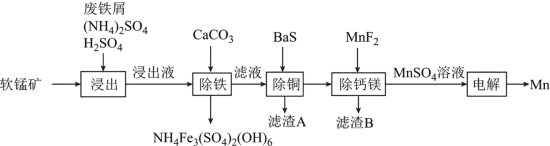
(1)废铁屑表面含有油脂,除去表面油脂的方法是___________ 。
(2)写出“浸出”时Fe与MnO2反应的离子方程式:___________ 。
(3)“除铁”时加入CaCO3的主要作用是___________ ;滤渣A的主要成分为___________ 、___________ (填化学式)。
(4)除铁后的滤液若酸性过强,加入BaS溶液后可能造成污染,原因是___________ 。(用离子反应方程式表示)
(5)电解硫酸锰溶液的装置示意图如下:
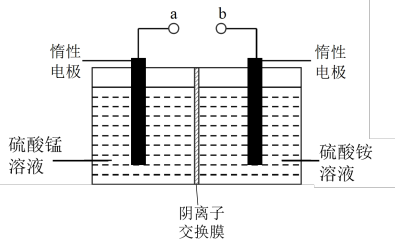
电解时Mn在___________ (填“阴”或“阳”)极析出,阳极产生O2的电极反应式为___________ ,阳极室的溶液可返回上述“___________ ”工序循环使用。

(1)废铁屑表面含有油脂,除去表面油脂的方法是
(2)写出“浸出”时Fe与MnO2反应的离子方程式:
(3)“除铁”时加入CaCO3的主要作用是
(4)除铁后的滤液若酸性过强,加入BaS溶液后可能造成污染,原因是
(5)电解硫酸锰溶液的装置示意图如下:

电解时Mn在
您最近一年使用:0次
名校
解题方法
2 . ClO2气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将ClO2制备成NaClO2固体以便运输和贮存,具体流程如图:
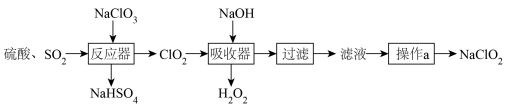
(1)反应器中,SO2的作用是________ (填“氧化剂”或“还原剂”)。
(2)吸收器中反应时有使带火星的木条复燃的气体产生,该反应的化学方程式是_______ 。
(3)已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2。操作a具体步骤:________ ,干燥,得到NaClO2固体。(可选用的试剂:无水乙醇)
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和H2SO4溶液发生如下反应:NaClO2+4KI+2H2SO4=2H2O+2I2+NaCl+2K2SO4,杂质不与KI反应。
③以淀粉作指示剂,再加入0.2000mol•L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为40.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
计算该样品中NaClO2的纯度________ 。
(5)以NaClO2和稀盐酸为原料制备ClO2进行水处理,其原理如下:NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,但在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:________ 。

(1)反应器中,SO2的作用是
(2)吸收器中反应时有使带火星的木条复燃的气体产生,该反应的化学方程式是
(3)已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2。操作a具体步骤:
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和H2SO4溶液发生如下反应:NaClO2+4KI+2H2SO4=2H2O+2I2+NaCl+2K2SO4,杂质不与KI反应。
③以淀粉作指示剂,再加入0.2000mol•L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为40.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
计算该样品中NaClO2的纯度
(5)以NaClO2和稀盐酸为原料制备ClO2进行水处理,其原理如下:NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,但在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:
您最近一年使用:0次
2023-10-24更新
|
185次组卷
|
2卷引用:广东省广州市第七中学2023-2024学年高一上学期11月期中考试化学试题
解题方法
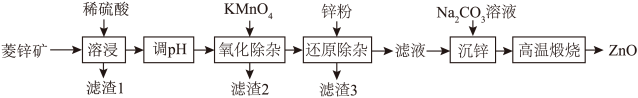
3 . ZnO是制备各种含锌材料的原料,在电镀、医疗上有广泛应用。一种以菱锌矿(主要成分为 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
已知:①“溶浸”后的溶液中金属离子主要有: 、
、 、
、 、
、 。
。
②在本实验条件下, 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。
③生成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为___________ 。

(2)“调pH”中,向“溶浸”后的溶液中加入___________ (填化学式)调节pH约为5。
(3)“氧化除杂”中发生反应的离子方程式分别是:① ,②
,②___________ 。
(4)“还原除杂”中,滤渣3的主要成分是___________ 及过量的锌粉,“还原除杂”的反应类型为___________ 。
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是___________ 。
(6)“沉锌”生成碱式碳酸锌的成分可能是 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=___________ 。
 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
已知:①“溶浸”后的溶液中金属离子主要有:
 、
、 、
、 、
、 。
。②在本实验条件下,
 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。③生成氢氧化物沉淀的pH见下表:
| 物质 |  |  |  |  |  |
| 开始沉淀时的pH | 1.5 | 6.3 | 6.2 | 6.9 | 8.1 |
| 沉淀完全时的pH | 2.8 | 8.3 | 8.2 | 8.9 | 10.1 |
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为

(2)“调pH”中,向“溶浸”后的溶液中加入
(3)“氧化除杂”中发生反应的离子方程式分别是:①
 ,②
,②(4)“还原除杂”中,滤渣3的主要成分是
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是
(6)“沉锌”生成碱式碳酸锌的成分可能是
 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
您最近一年使用:0次
解题方法
4 . 铵态氮肥的过度使用会导致水体的富营养化。氨氮( 和
和 )废水处理方法有化学法、离子交换法、生物法。回答下列问题:
)废水处理方法有化学法、离子交换法、生物法。回答下列问题:
(1)化学法可以用NaClO处理氨氮废水,NaClO和水中溶解的 反应得到无毒无害的物质,反应的离子方程式为:
反应得到无毒无害的物质,反应的离子方程式为: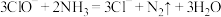 。该反应氧化剂与还原剂物质的量之比为
。该反应氧化剂与还原剂物质的量之比为___________ 。
(2)现探究化学法去除溶液中氨氮的最适宜条件。实验测定氨氮脱除率受溶液pH和 投料比例的影响。
投料比例的影响。
已知:
下表是不同pH下的氨氮脱除率:
下图是在最佳pH条件下, 投料比例不同的情况下的氨氮脱除率:
投料比例不同的情况下的氨氮脱除率:
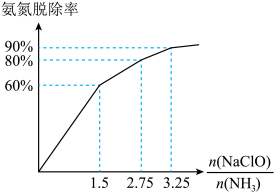
①由上述信息判断,反应的最佳pH范围是___________ ,最佳 投料比是
投料比是___________ 。
②实验测定在某酸性条件下, 投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因
投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因___________ 。
(3)离子交换法是利用 交换树脂,将氨氮废水中的
交换树脂,将氨氮废水中的 转化为
转化为 。用NaR表示
。用NaR表示 交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:
交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:___________ 。
(4)生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。在氧气较少的环境下,
。在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
①氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为___________ 。
②写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:___________ 。
 和
和 )废水处理方法有化学法、离子交换法、生物法。回答下列问题:
)废水处理方法有化学法、离子交换法、生物法。回答下列问题:(1)化学法可以用NaClO处理氨氮废水,NaClO和水中溶解的
 反应得到无毒无害的物质,反应的离子方程式为:
反应得到无毒无害的物质,反应的离子方程式为: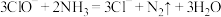 。该反应氧化剂与还原剂物质的量之比为
。该反应氧化剂与还原剂物质的量之比为(2)现探究化学法去除溶液中氨氮的最适宜条件。实验测定氨氮脱除率受溶液pH和
 投料比例的影响。
投料比例的影响。已知:

下表是不同pH下的氨氮脱除率:
| pH | 反应前氨元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 投料比例不同的情况下的氨氮脱除率:
投料比例不同的情况下的氨氮脱除率:
①由上述信息判断,反应的最佳pH范围是
 投料比是
投料比是②实验测定在某酸性条件下,
 投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因
投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因(3)离子交换法是利用
 交换树脂,将氨氮废水中的
交换树脂,将氨氮废水中的 转化为
转化为 。用NaR表示
。用NaR表示 交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:
交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:(4)生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。在氧气较少的环境下,
。在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。①氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为②写出
 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:
您最近一年使用:0次
名校
5 . 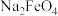 (其中铁元素的化合价为
(其中铁元素的化合价为 )是一种高效多功能水处理剂,一种制备
)是一种高效多功能水处理剂,一种制备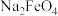 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: 。下列对此反应的说法中,
。下列对此反应的说法中,不正确 的是
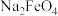 (其中铁元素的化合价为
(其中铁元素的化合价为 )是一种高效多功能水处理剂,一种制备
)是一种高效多功能水处理剂,一种制备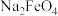 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: 。下列对此反应的说法中,
。下列对此反应的说法中,A.方框中的物质为 | B. 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
C. 和 和 均为氧化产物 均为氧化产物 | D.每生成1个 分子时,反应中共转移8个电子 分子时,反应中共转移8个电子 |
您最近一年使用:0次
2023-10-15更新
|
266次组卷
|
2卷引用:广东省广州市第二中学教育集团联考2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
6 . 工业上以辉铋矿粉(主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2等杂质)为原料制备铅酸钠的流程如下:

已知:NaBiO3(铋酸钠,浅黄色不溶于冷水的固体),请回答下列问题:
(1)用硝酸替代“盐酸,NaClO3”也可以实现“酸浸”,从环保角度考滤,存在的缺点是___________ 。
(2)检验“酸没液中是否含Fe2+,可选择的试剂是___________(填标号)。
(3)“氧化”的化学反应方程式为___________ 。
(4)已知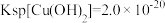 ,
,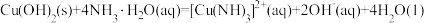 的平衡常数
的平衡常数 ,求
,求 的平衡常数K2=
的平衡常数K2=___________ 。
(5)铋酸钠纯度的测定
已知:在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末振荡,无色溶液变紫红色溶液。
取上述制得的NaBiO3粗产品mg,加入足量的稀硫酸和MnSO4稀溶液使其完全反应,再用nmol·L-1的H2C2O4标准溶液滴定,滴定到终点时的实验现象是___________ 。若滴定终点时消耗H2C2O4溶液VmL,NaBiO3的相对分子质量用M表示,则该产品的纯度是___________ 。(用含n、m、V、M的代数式表示)。

已知:NaBiO3(铋酸钠,浅黄色不溶于冷水的固体),请回答下列问题:
(1)用硝酸替代“盐酸,NaClO3”也可以实现“酸浸”,从环保角度考滤,存在的缺点是
(2)检验“酸没液中是否含Fe2+,可选择的试剂是___________(填标号)。
| A.KSCN溶液 | B.K3[Fe(CN)6]溶液 |
| C.KSCN溶液和双氧水 | D.KMnO4溶液 |
(4)已知
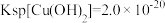 ,
,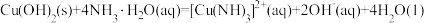 的平衡常数
的平衡常数 ,求
,求 的平衡常数K2=
的平衡常数K2=(5)铋酸钠纯度的测定
已知:在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末振荡,无色溶液变紫红色溶液。
取上述制得的NaBiO3粗产品mg,加入足量的稀硫酸和MnSO4稀溶液使其完全反应,再用nmol·L-1的H2C2O4标准溶液滴定,滴定到终点时的实验现象是
您最近一年使用:0次
名校
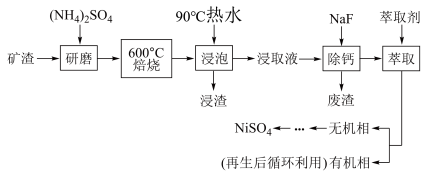
7 . NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。
。___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 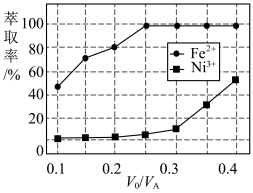
 。
。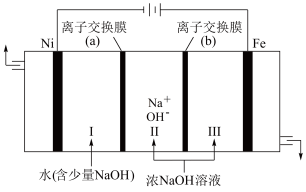
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近一年使用:0次
2023-10-03更新
|
553次组卷
|
7卷引用:2019-2020广东省广州市天河区东圃中学高三化学试卷(10月考)
8 . 废旧太阳能电池 CIGS 具有较高的回收利用价值,其主要组成为 CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:

回答下列问题:
(1)第 34 号元素硒(Se)与硫为同族元素,基态 Se 原子的简化电子排布式为___________ ;基态 Cu 原子的价电子排布图为___________ 。
(2)CuIn0.5Ga0.5Se2中 Cu 的化合价为+1,高温焙烧得到的烧渣主要成分是氧化物,则“酸浸氧化”发生的主要氧化还原反应的化学方程式为___________ 。
(3)SOCl2 分子空间结构为___________ 形。
(4)“高温气相沉积”过程中发生的化学反应方程式为___________ 。
(5)25℃时,已知:Kb( )≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,K[Cu(OH)2]≈1.0×10-20,“浸出液”中 c(Cu2+)=0.01mol·L-1.当金属阳离子浓度小于 1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的 pH 约为
)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,K[Cu(OH)2]≈1.0×10-20,“浸出液”中 c(Cu2+)=0.01mol·L-1.当金属阳离子浓度小于 1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的 pH 约为___________ (保留一位小数);为探究 Ga(OH)3在氨水中能否溶解,计算反应 Ga(OH)3+NH3·H2O [Ga(OH)4]-+
[Ga(OH)4]-+ 的平衡常数 K=
的平衡常数 K=___________ 。(已知:Ga3++4OH- [Ga(OH)4]-,
[Ga(OH)4]-, )
)

回答下列问题:
(1)第 34 号元素硒(Se)与硫为同族元素,基态 Se 原子的简化电子排布式为
(2)CuIn0.5Ga0.5Se2中 Cu 的化合价为+1,高温焙烧得到的烧渣主要成分是氧化物,则“酸浸氧化”发生的主要氧化还原反应的化学方程式为
(3)SOCl2 分子空间结构为
(4)“高温气相沉积”过程中发生的化学反应方程式为
(5)25℃时,已知:Kb(
 )≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,K[Cu(OH)2]≈1.0×10-20,“浸出液”中 c(Cu2+)=0.01mol·L-1.当金属阳离子浓度小于 1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的 pH 约为
)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,K[Cu(OH)2]≈1.0×10-20,“浸出液”中 c(Cu2+)=0.01mol·L-1.当金属阳离子浓度小于 1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的 pH 约为 [Ga(OH)4]-+
[Ga(OH)4]-+ 的平衡常数 K=
的平衡常数 K= [Ga(OH)4]-,
[Ga(OH)4]-, )
)
您最近一年使用:0次
名校
解题方法
9 . 工业制硫酸的原理示意图如图:

下列说法不正确的是

下列说法不正确的是
A.燃烧的化学方程式为4FeS2+11O2 2Fe2O3+8SO2 2Fe2O3+8SO2 |
| B.1mol SO2和足量O2充分反应转移2mol电子 |
| C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾 |
| D.可用浓氨水吸收生产过程中的尾气并转化为铵盐 |
您最近一年使用:0次
2023-09-14更新
|
199次组卷
|
3卷引用:广东省广州市2024届高三上学期9月阶段训练化学试题
名校
解题方法
10 . 铁及其化合物在生产生活中有着广泛的用途。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式: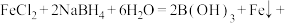
______ 。
②相同条件下,向水样Ⅰ和Ⅱ(含少量( )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中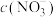 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是______ 。
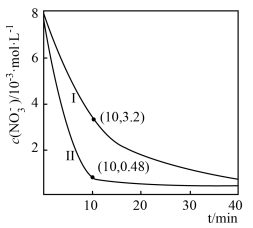
③在0~10 min内,Ⅱ中 的平均反应速率为
的平均反应速率为______ 。
(2)KSCN溶液可检验水样中的 .发生的反应为
.发生的反应为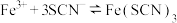 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。
(3)邻苯二酚类配体(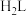 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、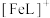 、
、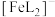 、
、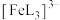 、
、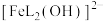 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
已知: 及
及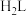 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,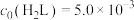 mol⋅L
mol⋅L 。
。
常温下,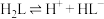
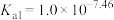 ,
,
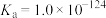 。
。
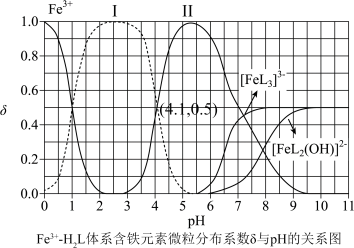
①苯酚酸性比邻甲基苯酚______ (填“强”“弱”或“无法判断”),邻苯二酚的熔点比对苯二酚低的原因为______ 。
②图中代表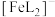 的曲线是
的曲线是______ (填“Ⅰ”或“Ⅱ”)。计算该温度下溶液中反应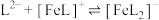 的平衡常数
的平衡常数
______ (写出计算过程)。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式:
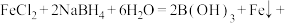
②相同条件下,向水样Ⅰ和Ⅱ(含少量(
 )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中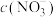 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
③在0~10 min内,Ⅱ中
 的平均反应速率为
的平均反应速率为(2)KSCN溶液可检验水样中的
 .发生的反应为
.发生的反应为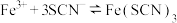 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。| A.增大KSCN溶液的浓度,平衡常数增大 |
B.加入少量铁粉,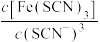 减小 减小 |
| C.加水稀释,平衡向左移动,溶液颜色变浅 |
D.加入少量 固体,平衡向右移动 固体,平衡向右移动 |
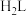 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、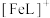 、
、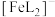 、
、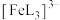 、
、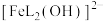 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。已知:
 及
及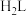 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,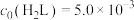 mol⋅L
mol⋅L 。
。常温下,
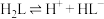
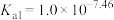 ,
,
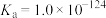 。
。
①苯酚酸性比邻甲基苯酚
②图中代表
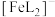 的曲线是
的曲线是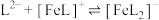 的平衡常数
的平衡常数
您最近一年使用:0次
2023-09-08更新
|
436次组卷
|
3卷引用:广东省广州市第六中学2024届高中毕业班第一次调研考试化学试题



