名校
1 . 工业制备硝酸的过程中,会产生氮的氧化物等空气污染物。为减少环境污染,需要用氢氧化钠溶液吸收尾气,反应的化学方程式为 ,则
,则 的化学式为
的化学式为
 ,则
,则 的化学式为
的化学式为A. | B. | C. | D.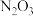 |
您最近半年使用:0次
名校
解题方法
2 . 以黄铜矿( )为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
)为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
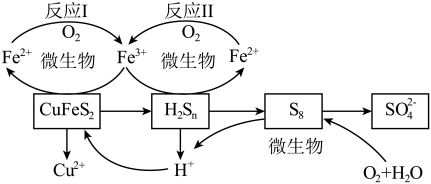
下列说法不正确的是
 )为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
)为主要原料的炼铜方法之一是生物浸出法:在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
下列说法不正确的是
A.反应Ⅰ、Ⅱ中的离子方程式均为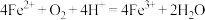 |
| B.此浸出过程,温度越高,浸出率越高 |
C.在微生物的作用下,可以循环使用的物质有 和 和 |
D.假如黄铜矿中的铁元素最终全部转化为 ,当有 ,当有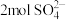 生成时,理论上消耗 生成时,理论上消耗 的物质的量为 的物质的量为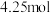 |
您最近半年使用:0次
2023-09-24更新
|
139次组卷
|
3卷引用:甘肃省张掖市高台县第一中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
3 . 硫酸铝在造纸、水净化、土壤改良中有着广泛应用。某化工厂利用含铅废料(成分为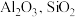 及少量
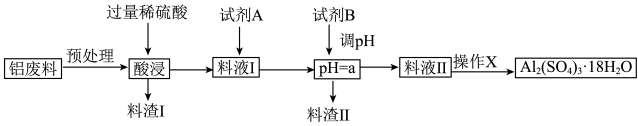
及少量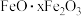 )制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
已知生成氢氧化物沉淀的 如下表:
如下表:
(1)“预处理”时需要将铝废料粉碎,目的是_______ 。
(2)料渣Ⅰ的成分是_______ ,酸浸时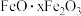 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)试剂 是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式
是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式_______ 。
(4) 的范围是
的范围是_______ ,试剂B最好是_______ ,目的是_______ 。(用离子方程式和必要的文字描述)
(5)操作 的内容是
的内容是_______ 、过滤、洗涤、干燥等。
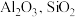 及少量
及少量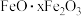 )制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
已知生成氢氧化物沉淀的
 如下表:
如下表: |  |  | |
开始沉淀时 | 3.6 | 6.3 | 2.3 |
完全沉淀时 | 4.9 | 8.3 | 3.2 |
(2)料渣Ⅰ的成分是
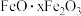 发生反应的离子方程式为
发生反应的离子方程式为(3)试剂
 是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式
是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式(4)
 的范围是
的范围是(5)操作
 的内容是
的内容是
您最近半年使用:0次
名校
解题方法
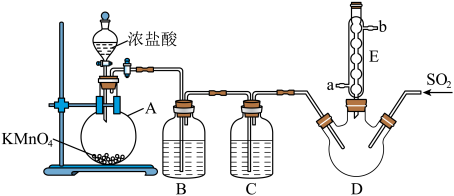
4 . 硫酰氯(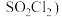 是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
已知:① (1)
(1)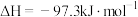 。
。
②常温下硫酰氯为无色液体,熔点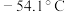 ,沸点
,沸点 ,在潮湿空气中“发烟”。
,在潮湿空气中“发烟”。
③ 以上或长时间存放硫酰氯都易分解,生成
以上或长时间存放硫酰氯都易分解,生成 和
和 。
。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是_______ (用化学方程式表示)。
(2)装置A中发生反应的离子方程式为_______ 。
(3)仪器 的名称为
的名称为_______ ,其作用是_______ 。
(4)整套装置存在一处明显的缺䧄,请你提出改进措施_______ 。
(5)当装置A中生成氯气 (已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为
(已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为_______ 。
(6)氯磺酸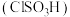 加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______ ,从分解的产物中分离出硫酰氯的操作方法是_______ 。
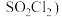 是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
是一种重要的化工试济,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
已知:①
 (1)
(1)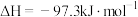 。
。②常温下硫酰氯为无色液体,熔点
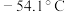 ,沸点
,沸点 ,在潮湿空气中“发烟”。
,在潮湿空气中“发烟”。③
 以上或长时间存放硫酰氯都易分解,生成
以上或长时间存放硫酰氯都易分解,生成 和
和 。
。回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是
(2)装置A中发生反应的离子方程式为
(3)仪器
 的名称为
的名称为(4)整套装置存在一处明显的缺䧄,请你提出改进措施
(5)当装置A中生成氯气
 (已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为
(已折算成标准状况)时,则最终得到纯净的硫酰氯5.4g。硫酰氯的产率为(6)氯磺酸
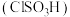 加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
5 . 大苏打 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ; 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为_______ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因_______ 。
(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
(4)向 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入 后形成溶液的溶质成分是
后形成溶液的溶质成分是_______ (填化学式);
②原 溶液的浓度为
溶液的浓度为_______  。
。
 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
| A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 |
| B.苏打和小苏打的相互转化属于可逆反应 |
C.采用加热法除去 溶液中混有的 溶液中混有的 |
| D.小苏打和全锌化铝均可治疗胃酸 |
 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入
 后形成溶液的溶质成分是
后形成溶液的溶质成分是②原
 溶液的浓度为
溶液的浓度为 。
。
您最近半年使用:0次
2023-09-24更新
|
49次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三上学期第一次诊断考试化学试题
名校
解题方法
6 . 在酸性条件下,黄铁矿 催化氧化的反应方程式为
催化氧化的反应方程式为 ,实现该反应的物质间转化如图所示。下列分析错误的是
,实现该反应的物质间转化如图所示。下列分析错误的是

 催化氧化的反应方程式为
催化氧化的反应方程式为 ,实现该反应的物质间转化如图所示。下列分析错误的是
,实现该反应的物质间转化如图所示。下列分析错误的是
A.反应Ⅰ的离子方程式为 |
B.反应Ⅱ的氧化剂是 |
| C.反应Ⅲ是氧化还原反应 |
D.黄铁矿催化氧化中 作催化剂 作催化剂 |
您最近半年使用:0次
名校
7 . 无水三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。通常是用不含水的三氧化二铬与卤化剂(如CCl4)在高温下反应,并使生成的三氯化铬在惰性气氛(如氮气)中升华来制取: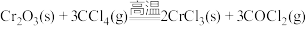 ,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
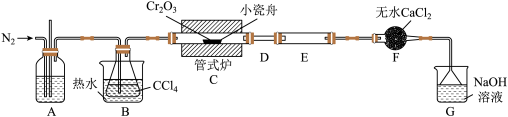
(1)A中的试剂为___________ ,长玻璃管的作用是___________ 。
(2)连接好装置后,先___________ ,再装入药品。在进行实验时,先___________ (填“通入N2”或“加热管式炉”);实验结束后,再持续通一段时间的N2,目的是___________ 。
(3)实验过程中若D处出现堵塞,应该采取的措施是___________ ,F中无水CaCl2的作用是___________ 。
(4)G装置的作用是___________ ,发生反应的离子方程式为___________ 。
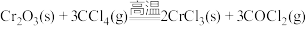 ,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
(1)A中的试剂为
(2)连接好装置后,先
(3)实验过程中若D处出现堵塞,应该采取的措施是
(4)G装置的作用是
您最近半年使用:0次
2023-09-23更新
|
250次组卷
|
7卷引用:甘肃省张掖市高台县第一中学2023-2024学年高三上学期9月月考化学试题
名校
8 . 工业上以软锰矿(含MnO2和少量的Fe2O3、Al2O3、SiO2)为原料制备硫酸锰晶体的流程如图所示,下列有关说法不正确的是


A.酸浸过程发生的主要反应的离子方程式为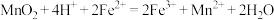 |
B.试剂A的目的是将过量 氧化为 氧化为 |
| C.试剂B可以是MnO或MnCO3 |
| D.滤渣1为H2SiO3,滤渣2为Fe(OH)3、Al(OH)3 |
您最近半年使用:0次
2023-09-23更新
|
459次组卷
|
8卷引用:甘肃省张掖市高台县第一中学2023-2024学年高三上学期9月月考化学试题
9 . 在离子方程式xR2++yH++O2=mR3++nH2O中,对系数m和R3+的判断正确的是
| A.m=4;R2+是氧化剂 |
| B.m=y;R3+是氧化产物 |
| C.m=2;R2+是氧化剂 |
| D.m=y;R3+是还原产物 |
您最近半年使用:0次
2023-08-25更新
|
312次组卷
|
2卷引用:甘肃省武威市凉州区部分校2023-2024学年高三上学期第二次模拟考试化学试题
名校
解题方法
10 . 高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH-→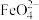 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
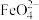 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| B.高铁酸钾中铁显+6价 |
C.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近半年使用:0次
2023-08-23更新
|
423次组卷
|
26卷引用:甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题
甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题(已下线)2012届山东莘县实验高中高三第三次月考化学试卷2016届北京市通州区潞河中学高三上学期期中测试化学试卷2017届四川省泸州市泸化中学高三上10月月考化学卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题广东省佛山市第一中学2020届高三10月月考化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应福建省永春第一中学2018-2019学年高二下学期期末考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)辽宁省沈阳市新民市第一高级中学2021-2022学年高三上学期第二次阶段测试化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高一上学期期中考试化学试卷【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)第二章 单元测试卷黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题河北省衡水市武强中学2023-2024学年高一上学期期中考试化学试题河北省石家庄精英中学2023-2024学年高一上学期期中考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题陕西省兴平市南郊高级中学2023-2024学年高一上学期第三次化学质量检测题



