名校
1 . 某化学自主实验小组通过实验探究 、
、 的性质。
的性质。
探究Ⅰ:利用如图所示装置探究 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。 的化学方程式是
的化学方程式是___________ 。
(2)甲、乙分别是___________ (填字母)。
a.浓硫酸、碱石灰 b.碱石灰、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
探究Ⅱ:探究 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。___________ 。
(6)G装置中浓硫酸有三种作用:混合 、
、 气体;干燥
气体;干燥 、
、 ;
;___________ 。
(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为___________  (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
 、
、 的性质。
的性质。探究Ⅰ:利用如图所示装置探究
 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 的化学方程式是
的化学方程式是(2)甲、乙分别是
a.浓硫酸、碱石灰 b.碱石灰、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是(4)此实验装置存在一个明显的缺陷是
探究Ⅱ:探究
 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。
(6)G装置中浓硫酸有三种作用:混合
 、
、 气体;干燥
气体;干燥 、
、 ;
;(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为
 (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
您最近半年使用:0次
2023-12-26更新
|
221次组卷
|
2卷引用:甘肃省武威市银科致远补习学校2023-2024学年高三上学期第三次调研化学试题
2023·黑龙江·模拟预测
2 . 向重铬酸盐酸性溶液中加入乙醚和 ,水层发生反应:
,水层发生反应: (已知
(已知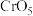 的结构为
的结构为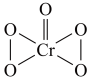 ),乙醚层发生反应:
),乙醚层发生反应: 。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(
。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色( ),下列说法正确的是
),下列说法正确的是
 ,水层发生反应:
,水层发生反应: (已知
(已知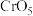 的结构为
的结构为 ),乙醚层发生反应:
),乙醚层发生反应: 。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(
。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色( ),下列说法正确的是
),下列说法正确的是A.由水层反应可知,氧化性: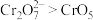 |
| B.乙醚在检验过程中可用乙醇代替 |
C.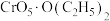 中不存在非极性键 中不存在非极性键 |
D.水相变为绿色的离子反应为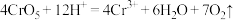 ,该反应生成 ,该反应生成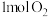 转移 转移 电子 电子 |
您最近半年使用:0次
解题方法
3 . 若做实验时不小心粘上高锰酸钾,皮肤上的斑要很久才能消除,而用 的稀溶液在稀硫酸条件下洗涤,可以马上消除,发生反应的化学方程式为
的稀溶液在稀硫酸条件下洗涤,可以马上消除,发生反应的化学方程式为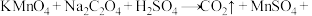

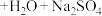 (未配平),下列关于此反应的叙述正确的是
(未配平),下列关于此反应的叙述正确的是
 的稀溶液在稀硫酸条件下洗涤,可以马上消除,发生反应的化学方程式为
的稀溶液在稀硫酸条件下洗涤,可以马上消除,发生反应的化学方程式为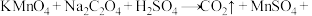

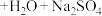 (未配平),下列关于此反应的叙述正确的是
(未配平),下列关于此反应的叙述正确的是A.当有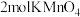 参加反应时,该反应转移10 mol电子 参加反应时,该反应转移10 mol电子 |
B.该反应右边方框内的产物是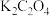 |
C.该反应的氧化剂是 |
D.配平后, 的化学计量数是10 的化学计量数是10 |
您最近半年使用:0次
解题方法
4 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
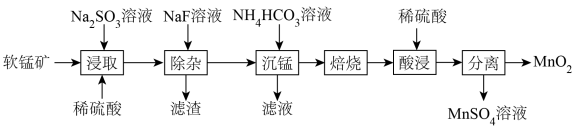
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
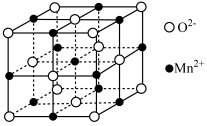
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近半年使用:0次
2023-12-08更新
|
291次组卷
|
2卷引用:甘肃省平凉市静宁县文萃中学2023-2024学年高三上学期第三次模拟考试化学试题
5 . 少量 与
与 溶液能发生如下反应:
溶液能发生如下反应: (方程式未配平),设
(方程式未配平),设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
A.1L 1  溶液含 溶液含 的数目为2 的数目为2 | B.1mol  可制得 可制得 的胶粒数为 的胶粒数为 |
C.78g  含有共价键的数目为 含有共价键的数目为 | D.每生成1mol X,转移的电子数为 |
您最近半年使用:0次
2023-12-01更新
|
153次组卷
|
6卷引用:广东省东莞市部分名校高三上(9月联考)-化学试题
名校
6 . I.过氧化氢H2O2俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_______ (填字母代号)。
(2)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______ 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。已知该反应H2O2只发生如下过程:H2O2→O2。写出该氧化还原反应的离子方程式:_______ 。
II.在H2O2的参与下,S2O (硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(4)若S2O 与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:_______ 。
_______Fe2++_______S2O +_______H2O2+_______OH-=_______Fe2O3+_______S2O
+_______H2O2+_______OH-=_______Fe2O3+_______S2O +_______H2O
+_______H2O
(5)下列关于该反应的说法中正确的是_______ (填序号)。
(6)每生成16gFe2O3纳米颗粒转移电子的物质的量为_______ mol。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是
(2)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。已知该反应H2O2只发生如下过程:H2O2→O2。写出该氧化还原反应的离子方程式:
II.在H2O2的参与下,S2O
 (硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。(4)若S2O
 与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:_______Fe2++_______S2O
 +_______H2O2+_______OH-=_______Fe2O3+_______S2O
+_______H2O2+_______OH-=_______Fe2O3+_______S2O +_______H2O
+_______H2O(5)下列关于该反应的说法中正确的是
A.该反应中的还原剂只有S2O |
| B.已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体 |
| C.该反应中H2O2只作氧化剂 |
| D.该反应需要在碱性条件下进行 |
您最近半年使用:0次
名校
解题方法
7 . 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:
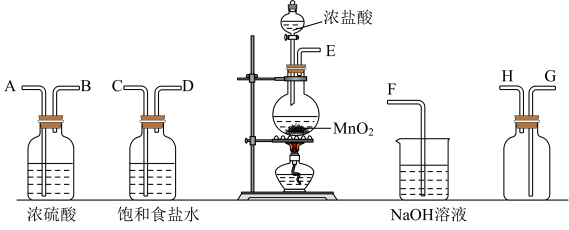
(1)盛有浓盐酸的仪器名称_______ ,装置的正确连接顺序为E→_______ →F。
(2)气体发生装置中发生反应的化学方程式为_______ 。
(3)装置中饱和食盐水的作用是_______ 。
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用_______ 。
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:
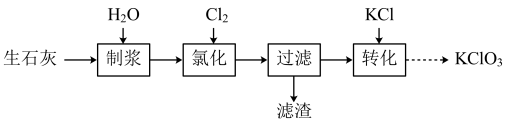
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是_______ 。
(6)根据如图的溶解度曲线(如图),回答下列问题。
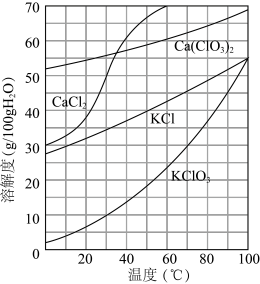
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是_______ 。若溶液中KClO3的含量为100g•L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______ 。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:

(1)盛有浓盐酸的仪器名称
(2)气体发生装置中发生反应的化学方程式为
(3)装置中饱和食盐水的作用是
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是
(6)根据如图的溶解度曲线(如图),回答下列问题。

向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是
您最近半年使用:0次
名校
解题方法
8 . 硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出):
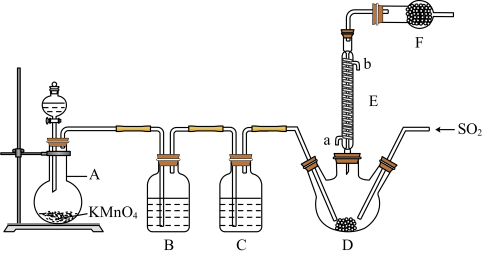
已知:
①SO2(g)+Cl2(g) SO2Cl2(1) △H=-97.3kJ/mol。
SO2Cl2(1) △H=-97.3kJ/mol。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ 。
(2)装置B的作用为_______ ,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_______ 。
(3)仪器F的名称为_______ ,E中冷凝水的入口是_______ (填“а”或“b”),F的作用除了防止空气中水蒸气进入D装置内之外,还可以_______ 。
(4)当装置A中排出氯气1.12L(已折算成标准状况)时,最终得到4.05g纯净的硫酰氯,则硫酰氯的产率为_______ 。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______ (填序号)。
①加热三颈烧瓶
②控制气流速率,不宜过快
③若三颈烧瓶发烫,可适当降温
④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是_______ 。

已知:
①SO2(g)+Cl2(g)
 SO2Cl2(1) △H=-97.3kJ/mol。
SO2Cl2(1) △H=-97.3kJ/mol。②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置B的作用为
(3)仪器F的名称为
(4)当装置A中排出氯气1.12L(已折算成标准状况)时,最终得到4.05g纯净的硫酰氯,则硫酰氯的产率为
①加热三颈烧瓶
②控制气流速率,不宜过快
③若三颈烧瓶发烫,可适当降温
④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是
| A.重结晶 | B.过滤 | C.蒸馏 | D.萃取 |
您最近半年使用:0次
名校
解题方法
9 . 高铁酸钾((K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如图:
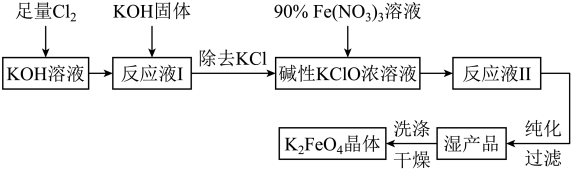
已知:①Cl2与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO、H2O;温度较高时产物为NaCl、NaClO3、H2O。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出此工艺流程中Cl2通入KOH溶液的化学方程式:_______ 。
(2)在“反应液I”中加入KOH固体的目的是①_______ ,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO浓溶液反应的离子方程式:_______ 。
(4)从“反应液Ⅱ”中分离出K2FeO4后,副产品是_______ (写化学式)。
(5)K2FeO4可作为新型多功能水处理剂的原因是:①_______ ,②_______ 。
(6)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为_______ mol。

已知:①Cl2与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO、H2O;温度较高时产物为NaCl、NaClO3、H2O。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出此工艺流程中Cl2通入KOH溶液的化学方程式:
(2)在“反应液I”中加入KOH固体的目的是①
(3)写出Fe(NO3)3溶液与碱性KClO浓溶液反应的离子方程式:
(4)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
(5)K2FeO4可作为新型多功能水处理剂的原因是:①
(6)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为
您最近半年使用:0次
2023-11-07更新
|
171次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
10 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
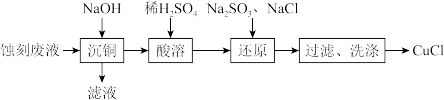

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近半年使用:0次
2023-11-07更新
|
639次组卷
|
5卷引用:甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题
甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题



