1 . H2O2是重要的化学试剂,在实验室和实际生产中应用广泛。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:______________ 。
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是___________ 。
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:___________ 。
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是___________ 。
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
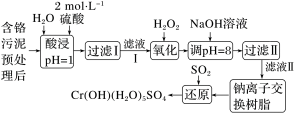
已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为 ,写出此反应的离子方程式:
,写出此反应的离子方程式: ___________ 。
(3)H2O2是一种二元弱酸,写出其第一步电离的方程式:___________ ,它与过量的Ba(OH)2反应的化学方程式为________________ 。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:

已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为
 ,写出此反应的离子方程式:
,写出此反应的离子方程式: (3)H2O2是一种二元弱酸,写出其第一步电离的方程式:
您最近半年使用:0次
23-24高三上·江西·阶段练习
2 . 回答下列问题:
(1)金属与硝酸反应通常不能生成 ,用过量3mol/L
,用过量3mol/L  与铁粉反应,
与铁粉反应, 的还原产物主要是NO,请写出反应的离子方程式:
的还原产物主要是NO,请写出反应的离子方程式:_______ 。
有同学在查阅文献时发现文献有记载: 与铁反应能产生
与铁反应能产生 。于是其小组进行了金属铁与硝酸反应能否产生
。于是其小组进行了金属铁与硝酸反应能否产生 及其有利条件的探究。
及其有利条件的探究。
实验Ⅰ:20℃,将过量铁粉溶于
 ,立即有无色气体生成,充分反应后,溶液几乎无色。
,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。 ,不含NO。实验证据是
,不含NO。实验证据是_______ 。
(3)检验溶液:取上层清液,等分两份
①向一份滴加 溶液,产生
溶液,产生_______ ,说明含有 。
。
②向另一份加入 溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有
溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有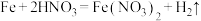 ,另外还有
,另外还有_______ (写出化学方程式)。
对 产生的原因提出假设:在稀的酸性溶液中,
产生的原因提出假设:在稀的酸性溶液中, 中
中 的氧化性大于
的氧化性大于 ,验证如下:
,验证如下:
(4)实验Ⅱ:将铜粉溶于
 。经检测,发现没有
。经检测,发现没有_______ (填化学式)生成,初步证实假设不成立。
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL 
 ,中加入过量铁粉,结果如下:
,中加入过量铁粉,结果如下:
经检验,实验Ⅲ、Ⅳ、Ⅴ中, 的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高
的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高 体积减少的原因
体积减少的原因_______ 。
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是_______ 。
(1)金属与硝酸反应通常不能生成
 ,用过量3mol/L
,用过量3mol/L  与铁粉反应,
与铁粉反应, 的还原产物主要是NO,请写出反应的离子方程式:
的还原产物主要是NO,请写出反应的离子方程式:有同学在查阅文献时发现文献有记载:
 与铁反应能产生
与铁反应能产生 。于是其小组进行了金属铁与硝酸反应能否产生
。于是其小组进行了金属铁与硝酸反应能否产生 及其有利条件的探究。
及其有利条件的探究。实验Ⅰ:20℃,将过量铁粉溶于

 ,立即有无色气体生成,充分反应后,溶液几乎无色。
,立即有无色气体生成,充分反应后,溶液几乎无色。(2)检验气体:方法如图所示。
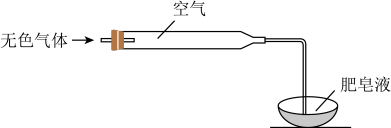
 ,不含NO。实验证据是
,不含NO。实验证据是(3)检验溶液:取上层清液,等分两份
①向一份滴加
 溶液,产生
溶液,产生 。
。②向另一份加入
 溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有
溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有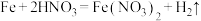 ,另外还有
,另外还有对
 产生的原因提出假设:在稀的酸性溶液中,
产生的原因提出假设:在稀的酸性溶液中, 中
中 的氧化性大于
的氧化性大于 ,验证如下:
,验证如下:(4)实验Ⅱ:将铜粉溶于

 。经检测,发现没有
。经检测,发现没有(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示
 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL 
 ,中加入过量铁粉,结果如下:
,中加入过量铁粉,结果如下:| 实验序号 | Ⅲ | Ⅳ | Ⅴ |
| 温度 | 20℃ | 40℃ | 60℃ |
生成 体积 体积 | 6.0mL | 3.4 mL | 2.6 mL |
 的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高
的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高 体积减少的原因
体积减少的原因(6)综上所述,有利于金属与硝酸反应生成氢气的条件是
您最近半年使用:0次
2024-02-26更新
|
403次组卷
|
3卷引用:专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省五市九校协作体2023-2024学年高三上学期第一次联考化学试题河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题
20-21高三上·黑龙江哈尔滨·期末
名校
解题方法
3 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: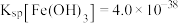 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、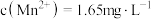 。
。
①若要除尽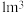 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 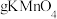 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中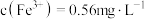 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: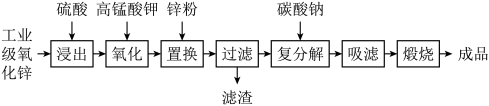
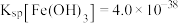 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、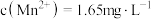 。
。①若要除尽
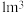 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入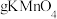 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中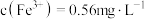 ,若溶液
,若溶液 ,则此时
,则此时
您最近半年使用:0次
2024-02-20更新
|
204次组卷
|
3卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
23-24高三上·安徽合肥·期末
名校
解题方法
4 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素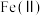 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与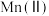 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内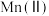 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
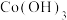 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中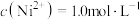 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中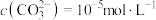 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。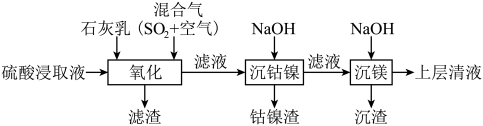
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
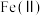 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与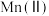 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内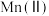 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是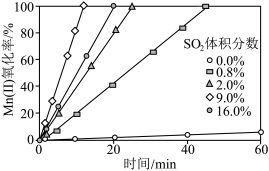
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成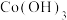 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
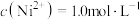 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中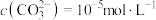 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近半年使用:0次
2024-02-17更新
|
441次组卷
|
4卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
23-24高三上·安徽·阶段练习
名校
解题方法
5 . 锰酸锂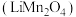 可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为
可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为 ,含少量
,含少量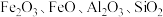 等杂质)吸收含硫烟气(主要成分
等杂质)吸收含硫烟气(主要成分 )制备
)制备 ,生产流程如下:
,生产流程如下:
②在此流程中部分金属阳离子生成氢氧化物沉淀的 如下表:
如下表:
回答下列问题:
(1)滤渣1为________ (填化学式); 被
被 还原为
还原为 的离子方程式为
的离子方程式为_________ 。
(2)由“滤液1”得到“滤液2”同时回收 的实验方案为[
的实验方案为[ 在
在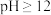 时溶解]:边搅拌边向滤液1中滴加足量
时溶解]:边搅拌边向滤液1中滴加足量___________ ;搅拌,加入 溶液至
溶液至___________ ,过滤得滤液2和固体;向所得固体中加入___________ 溶液至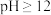 ,搅拌、过滤,再向所得滤液中通入
,搅拌、过滤,再向所得滤液中通入___________ ,___________ 、___________ 、低温烘干得 (实验中须用到的试剂有:
(实验中须用到的试剂有: 溶液、
溶液、 溶液、
溶液、 )。
)。
(3)已知室温下, ,当
,当 时,要使
时,要使 形成沉淀,
形成沉淀,
___________ 。
(4)在实际生产中, 与
与 按物质的量之比
按物质的量之比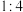 混合后,均匀加热制取
混合后,均匀加热制取 ,反应过程如下:
,反应过程如下:
①升温到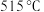 时,
时, 开始分解产生
开始分解产生 ,同时生成固体
,同时生成固体 ,此时比预计
,此时比预计 的分解温度
的分解温度 低得多,原因可能是
低得多,原因可能是___________ 。
②升温到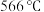 时,
时, 开始分解产生另一种气体
开始分解产生另一种气体 ,完全反应后,
,完全反应后, 恰好与①中产生的
恰好与①中产生的 的物质的量相等,同时得到固体
的物质的量相等,同时得到固体 。则固体
。则固体 的化学式为
的化学式为___________ 。
③升温到 时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的
时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的 。写出该阶段反应的化学方程式:
。写出该阶段反应的化学方程式:___________ 。
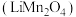 可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为
可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为 ,含少量
,含少量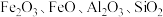 等杂质)吸收含硫烟气(主要成分
等杂质)吸收含硫烟气(主要成分 )制备
)制备 ,生产流程如下:
,生产流程如下: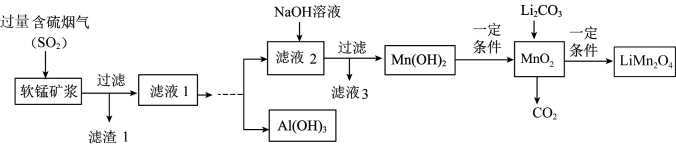
②在此流程中部分金属阳离子生成氢氧化物沉淀的
 如下表:
如下表:| 沉淀物 |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)滤渣1为
 被
被 还原为
还原为 的离子方程式为
的离子方程式为(2)由“滤液1”得到“滤液2”同时回收
 的实验方案为[
的实验方案为[ 在
在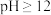 时溶解]:边搅拌边向滤液1中滴加足量
时溶解]:边搅拌边向滤液1中滴加足量 溶液至
溶液至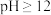 ,搅拌、过滤,再向所得滤液中通入
,搅拌、过滤,再向所得滤液中通入 (实验中须用到的试剂有:
(实验中须用到的试剂有: 溶液、
溶液、 溶液、
溶液、 )。
)。(3)已知室温下,
 ,当
,当 时,要使
时,要使 形成沉淀,
形成沉淀,
(4)在实际生产中,
 与
与 按物质的量之比
按物质的量之比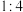 混合后,均匀加热制取
混合后,均匀加热制取 ,反应过程如下:
,反应过程如下:①升温到
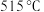 时,
时, 开始分解产生
开始分解产生 ,同时生成固体
,同时生成固体 ,此时比预计
,此时比预计 的分解温度
的分解温度 低得多,原因可能是
低得多,原因可能是②升温到
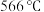 时,
时, 开始分解产生另一种气体
开始分解产生另一种气体 ,完全反应后,
,完全反应后, 恰好与①中产生的
恰好与①中产生的 的物质的量相等,同时得到固体
的物质的量相等,同时得到固体 。则固体
。则固体 的化学式为
的化学式为③升温到
 时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的
时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的 。写出该阶段反应的化学方程式:
。写出该阶段反应的化学方程式:
您最近半年使用:0次
2024-02-10更新
|
220次组卷
|
3卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)甘肃省2023-2024学年高三普通高中学业水平选择性考试仿真模拟卷(二)化学试卷安徽师范大学附属中学2024届高三1月月考化学试卷
2024·山西晋城·一模
6 . 实验室利用含钴废渣[含Co(OH)3、Fe(OH)3等]制备磁性材料Co3O4。回答下列问题:
I.稀硫酸的配制。
(1)实验室里需要450mL2mol·L-1H2SO4溶液。用98%浓硫酸(密度为1.84g·cm-3)配制该溶液时,下列仪器不需要用到的是___________ (填标号)。

(2)所需的浓硫酸的体积为___________ (保留1位小数)mL。
(3)配制过程中,下列操作将导致溶液浓度偏小的是___________ (填标号)。
Ⅱ.浸取。将一定量的钴渣粉与Na2SO3溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃下通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
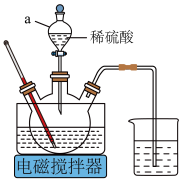
(4)仪器a的名称为___________ 。
(5)该过程中,Co(OH)3转化为Co2+的离子方程式为___________ 。
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成Co(OH)2、CoCO3和CoC2O4等多种形式的沉淀。
已知:向0.100mol/LCoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。
(6)向除杂后的CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4·2H2O。不能用同浓度的Na2C2O4溶液代替(NH4)2C2O4溶液的原因是___________ 。
Ⅳ.制备Co3O4。将所得的18.3g草酸钴晶体(CoC2O4·2H2O)高温灼烧,其热重分析图如图:
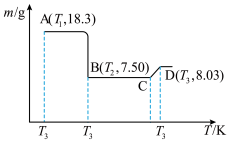
(7)写出B点对应的物质的化学式:___________ ,CD段发生反应的化学方程式为___________ 。
I.稀硫酸的配制。
(1)实验室里需要450mL2mol·L-1H2SO4溶液。用98%浓硫酸(密度为1.84g·cm-3)配制该溶液时,下列仪器不需要用到的是

(2)所需的浓硫酸的体积为
(3)配制过程中,下列操作将导致溶液浓度偏小的是___________ (填标号)。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.浸取。将一定量的钴渣粉与Na2SO3溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃下通过仪器a缓慢滴加稀硫酸,充分反应,过滤。

(4)仪器a的名称为
(5)该过程中,Co(OH)3转化为Co2+的离子方程式为
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成Co(OH)2、CoCO3和CoC2O4等多种形式的沉淀。
已知:向0.100mol/LCoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。
(6)向除杂后的CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4·2H2O。不能用同浓度的Na2C2O4溶液代替(NH4)2C2O4溶液的原因是
Ⅳ.制备Co3O4。将所得的18.3g草酸钴晶体(CoC2O4·2H2O)高温灼烧,其热重分析图如图:

(7)写出B点对应的物质的化学式:
您最近半年使用:0次
2024·安徽·模拟预测
名校
解题方法
7 . 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和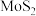 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
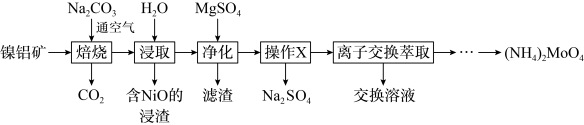
回答下列问题:
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。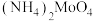 中钼元素的化合价为
中钼元素的化合价为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______ 。
(4) 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。

(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______ ”步骤。
(6)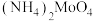 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为_______ 。
 )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和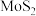 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
回答下列问题:
(1)
 位于元素周期表第
位于元素周期表第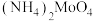 中钼元素的化合价为
中钼元素的化合价为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
(4)
 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)
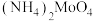 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为
您最近半年使用:0次
2024-01-22更新
|
1061次组卷
|
7卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)T16-工业流程题(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
2024·贵州·模拟预测
8 . 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下: 是一种铵盐;
是一种铵盐;
② 在溶液中常以
在溶液中常以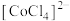 (蓝色)和
(蓝色)和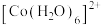 (粉红色)形式存在;
(粉红色)形式存在;
③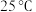 时,
时, 。
。
回答下列问题:
(1) 中
中 的化合价为
的化合价为_______ 。
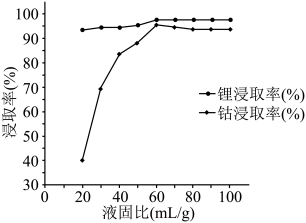
(2)下图为“微波共熔”中氯化胆碱-草酸和 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为_______  。
。_______ 。
(4) 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时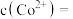
_______  。
。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是_______ 。
(6)“高温烧结”中需要通入空气,其作用是_______ 。
(7)锂离子电池正极材料 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。
① 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为_______ (用离子符号表示)。
②使用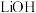 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为_______ 。
 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下:
 是一种铵盐;
是一种铵盐;②
 在溶液中常以
在溶液中常以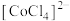 (蓝色)和
(蓝色)和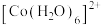 (粉红色)形式存在;
(粉红色)形式存在;③
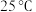 时,
时, 。
。回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)下图为“微波共熔”中氯化胆碱-草酸和
 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为 。
。
(4)
 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时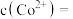
 。
。(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是
(6)“高温烧结”中需要通入空气,其作用是
(7)锂离子电池正极材料
 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。①
 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为②使用
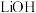 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为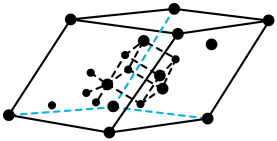
您最近半年使用:0次
2024-01-22更新
|
1049次组卷
|
5卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T16-工业流程题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题
名校
9 . 写出下列反应的方程式:
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式___________ 。
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式___________ 。
(3)漂白粉在空气中生效的化学方程式___________ 。
(4)请写出次氯酸光照分解的离子方程式___________ 。
(5) 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式______ 。
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式
(3)漂白粉在空气中生效的化学方程式
(4)请写出次氯酸光照分解的离子方程式
(5)
 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式
您最近半年使用:0次
23-24高三上·黑龙江·期末
名校
10 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1),已知它易溶于水,难溶于乙醇,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是___________ 。
(2)下列说法不正确的是 ___________。
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称___________ 。
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为___________ 。
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 ___________ 。
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①出“步骤2”中反应的离子方程式___________ 。
②试计算Na2S2O3·5H2O的纯度___________ 。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是 ___________。
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.反应后趁热过滤是除去硫等不溶物 |
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O
 +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 (6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。①出“步骤2”中反应的离子方程式
②试计算Na2S2O3·5H2O的纯度
您最近半年使用:0次
2024-01-18更新
|
263次组卷
|
3卷引用:专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)黑龙江省牡丹江市第一中学2023-2024学年高三上学期 期末化学试卷新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题



