解题方法
1 . 高铁酸盐(如K2FeO4)可用于净水。某化学小组同学进行以下两组实验,在制得氢氧化铁的基础上制备高铁酸盐。已知,①Fe2+对双氧水的分解有一定的催化作用;②制备高铁酸钾的反应原理为3C12+2Fe(OH)3+1OKOH=2K2FeO4+6KC1+8H2O。回答下列问题:
实验Ⅰ:取100mL饱和FeSO4溶液,滴加12%硫酸酸化的双氧水,再慢慢加入5mol/L的NaOH溶液;
(1)实验Ⅰ滴加双氧水的过程中,观察到溶液颜色变成黄色:其反应的离子方程式为_______ ,在溶液变成黄色的同时,看到不断有气泡产生,其原因是_________ 。
(2)完成实验Ⅰ后,及时对烧杯壁上附着的Fe(OH)3进行了清洗,但错把氢碘酸(HI,强酸)当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质(I2)。他们认为可能是Fe(OH)3和HI反应生成了I2,配平该反应的离子方程式:______ ,__Fe(OH)3+___H++___I-=Fe2++__I2+H2O。
实验Ⅱ:在实验I的基础上用制得的Fe(OH)3合成K2FeO4,其装置如下(夹持仪器已略去):
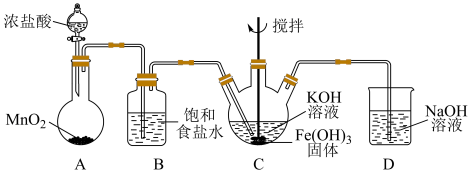
(3)上述装置中的明显错误是________ 。
(4)装置D中NaOH溶液的作用是______ 。
(5)若要制得19.8gK2FeO4,理论上需要浓盐酸的物质的量为_____ mol,但实验发现,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:________ 。
(6)研究发现,酸性条件下,几种氧化剂的氧化性强弱关系为K2FeO4>KMnO4>Cl2,结合实验Ⅱ中信息,判断K2FeO4的氧化性强弱与_______ 有关。
实验Ⅰ:取100mL饱和FeSO4溶液,滴加12%硫酸酸化的双氧水,再慢慢加入5mol/L的NaOH溶液;
(1)实验Ⅰ滴加双氧水的过程中,观察到溶液颜色变成黄色:其反应的离子方程式为
(2)完成实验Ⅰ后,及时对烧杯壁上附着的Fe(OH)3进行了清洗,但错把氢碘酸(HI,强酸)当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质(I2)。他们认为可能是Fe(OH)3和HI反应生成了I2,配平该反应的离子方程式:
实验Ⅱ:在实验I的基础上用制得的Fe(OH)3合成K2FeO4,其装置如下(夹持仪器已略去):

(3)上述装置中的明显错误是
(4)装置D中NaOH溶液的作用是
(5)若要制得19.8gK2FeO4,理论上需要浓盐酸的物质的量为
(6)研究发现,酸性条件下,几种氧化剂的氧化性强弱关系为K2FeO4>KMnO4>Cl2,结合实验Ⅱ中信息,判断K2FeO4的氧化性强弱与
您最近半年使用:0次
2 . 某离子反应涉及H+、Bi3+、 、
、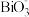 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断正确的是
)随反应进行逐渐增大。下列判断正确的是
 、
、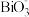 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断正确的是
)随反应进行逐渐增大。下列判断正确的是A.该反应中 作氧化剂 作氧化剂 |
| B.反应过程中溶液的pH变小 |
| C.氧化产物与还原产物的物质的量之比为5∶2 |
| D.若有1mol氧化剂参加反应,转移电子的物质的量为2mol |
您最近半年使用:0次
3 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某工厂烟灰(主要成分为MgO、 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(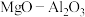 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(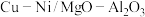 )的工艺流程如下:
)的工艺流程如下:

已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
回答下列问题:
(1)为加快浸取速率,可采取的措施是___________ (写出一条即可)。
(2)“浸取”过程中NiO发生反应的离子方程式为___________ ,“滤渣”的主要成分是___________ (填化学式)。
(3)加热时尿素 在水中发生水解反应生成
在水中发生水解反应生成 和
和___________ 气体(写化学式)。
(4)25℃时若“晶化、过滤”所得滤液中 ,则滤液中的
,则滤液中的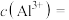
___________  。
。
(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为___________ 。
(6)“洗涤”过程中检验滤饼是否洗干净的方法为___________ ;“洗涤、干燥”之后的工序为___________ 。
 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(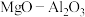 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(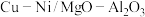 )的工艺流程如下:
)的工艺流程如下:
已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 3.4 | 4.8 | 7.7 | 9.1 |
完全沉淀时(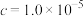 )的pH )的pH | 5.0 | 6.7 | 9.5 | 11.2 |
(1)为加快浸取速率,可采取的措施是
(2)“浸取”过程中NiO发生反应的离子方程式为
(3)加热时尿素
 在水中发生水解反应生成
在水中发生水解反应生成 和
和(4)25℃时若“晶化、过滤”所得滤液中
 ,则滤液中的
,则滤液中的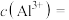
 。
。(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为
(6)“洗涤”过程中检验滤饼是否洗干净的方法为
您最近半年使用:0次
名校
4 . 三氧化二砷(俗称砒霜,分子式As2O3)微溶于水。主要用于提炼单质砷及冶炼砷合金和制造半导体。从硫化砷渣(含As2S3、CuS、Bi2S3)中回收As2O3的流程如下:

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为___________ ,该工序需要将硫化砷渣粉碎,其目的是___________ ;碱浸渣的主要成分为___________ (写化学式)。
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为___________ 。
(3)下列有关硫黄的性质和用途的说法错误的是___________ (填字母)。
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
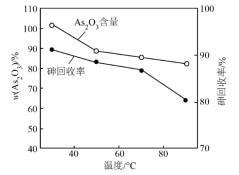
(4)“还原”时,反应的离子方程式为___________ ;该过程中,反应温度对产物中As2O3含量和砷的回收率的影响如图所示。随着温度升高,As2O3含量和砷的回收率逐渐降低的原因可能是___________ (写一点即可)。
(5)设计流程a、b的目的是___________ 。

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为
(3)下列有关硫黄的性质和用途的说法错误的是
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
(4)“还原”时,反应的离子方程式为

(5)设计流程a、b的目的是
您最近半年使用:0次
23-24高三上·安徽·阶段练习
名校
解题方法
5 . SO2和NO2是主要大气污染物,利用如图装置可同时吸收SO2和NO。已知电解池的阴极室中溶液的pH保持在4~7之间。下列说法正确的是


| A.电极a为直流电源的正极 |
| B.电解过程中,阳极区电解液的pH增大 |
C.阴极反应式为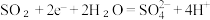 |
D.吸收NO的离子方程式为2NO+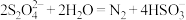 |
您最近半年使用:0次
6 . 化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋( ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是________ (填序号)。
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用________ (填序号)来鉴别,若白色固体是结晶苏打,观察到的现象是________ 。
(3)酸性 和
和 会发生如下反应:
会发生如下反应:______
________ ________
________ ________
________ ________
________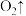 (配平上述方程式)。
(配平上述方程式)。
(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:________ 。
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:________ 。
①食盐(NaCl) ②食醋(
 ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用
(3)酸性
 和
和 会发生如下反应:
会发生如下反应:________
 ________
________ ________
________ ________
________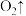 (配平上述方程式)。
(配平上述方程式)。(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:
您最近半年使用:0次
名校
7 . 84消毒液是常用消毒剂,主要成分为NaClO,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
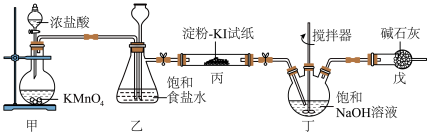
(1)装置甲中盛放浓盐酸的仪器名称是___________ ,装置甲中反应的离子方程式为___________ 。
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为___________ 。
(3)装置丁制备 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为___________ 。
(4)装置戊的作用是___________ 。
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为___________ ;猜测2可能为___________ 。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到___________ ,则证明猜测1正确。
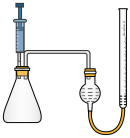

(1)装置甲中盛放浓盐酸的仪器名称是
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为
(3)装置丁制备
 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为(4)装置戊的作用是
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到

您最近半年使用:0次
2024-01-13更新
|
139次组卷
|
2卷引用:甘肃省酒泉市2023-2024学年高二上学期1月期末化学试题
名校
8 . 已知某反应的反应物与生成物为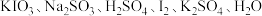 和未知物X,其中
和未知物X,其中 是反应物之一,下列说法错误的是
是反应物之一,下列说法错误的是
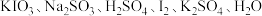 和未知物X,其中
和未知物X,其中 是反应物之一,下列说法错误的是
是反应物之一,下列说法错误的是A.未知物X为 | B.该反应的氧化剂是 |
C.还原性: | D.该反应中, 发生氧化反应 发生氧化反应 |
您最近半年使用:0次
23-24高三上·宁夏吴忠·阶段练习
名校
9 . 实验室以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备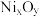 和碳酸钴
和碳酸钴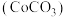 的工艺流程如图。
的工艺流程如图。
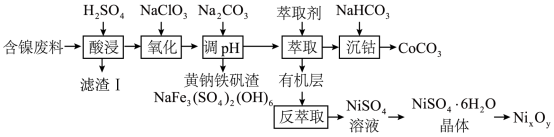
请回答以下问题:
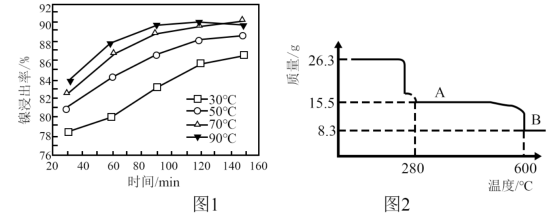
(1)“滤渣I”主要成分是______ ,“酸浸”过程中镍的浸出率与温度和时间的关系如图1所示,酸浸的最佳温度和时间是______ 。
(2)“氧化”时反应的离子方程式是______ ,实际生产中为了减少杂质离子的引入,可以用来替代 的试剂是
的试剂是______ 。
(3)“调pH”过程中, 不能过量的原因是
不能过量的原因是______ ,“沉钴”时反应的离子方程式是______ 。
(4)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
从 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、______ 。
(5) 晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为______ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备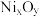 和碳酸钴
和碳酸钴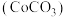 的工艺流程如图。
的工艺流程如图。
请回答以下问题:

(1)“滤渣I”主要成分是
(2)“氧化”时反应的离子方程式是
 的试剂是
的试剂是(3)“调pH”过程中,
 不能过量的原因是
不能过量的原因是(4)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(5)
 晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
您最近半年使用:0次
2023高三上·辽宁大连·专题练习
名校
10 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,用1.0×10﹣4mol•L﹣1的Na2S2O3溶液滴定(已知:2S2O +I2═S4O
+I2═S4O +2I﹣)。
+2I﹣)。
①加入的指示剂是_______ ,达到滴定终点时的现象是 _______ ;
②已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中ClO2的浓度是_______ mol•L﹣1。
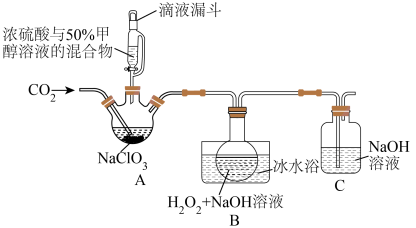
(2)亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
已知:
①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(Ⅰ)装置B中生成NaClO2的化学方程式是_______ 。
(Ⅱ)从反应后的B溶液中制得NaClO2晶体的操作步骤是:
a.控制在38~60℃之间蒸发浓缩、结晶;
b._______ ;
c.用38~60℃的热水洗涤;
d.在低于60℃的真空中蒸发,干燥。
(1)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,用1.0×10﹣4mol•L﹣1的Na2S2O3溶液滴定(已知:2S2O
 +I2═S4O
+I2═S4O +2I﹣)。
+2I﹣)。①加入的指示剂是
②已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中ClO2的浓度是
(2)亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:

已知:
①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(Ⅰ)装置B中生成NaClO2的化学方程式是
(Ⅱ)从反应后的B溶液中制得NaClO2晶体的操作步骤是:
a.控制在38~60℃之间蒸发浓缩、结晶;
b.
c.用38~60℃的热水洗涤;
d.在低于60℃的真空中蒸发,干燥。
您最近半年使用:0次



