名校
解题方法
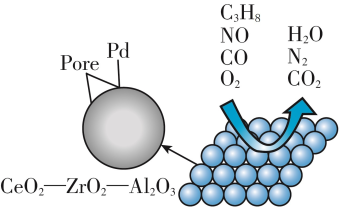
1 . 为解决汽车尾气达标排放,催化剂及其载体的选择和改良是关键。目前我国研制的稀土催化剂具有很好的催化转化效果,催化过程图如下。__________ 。
(2)CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。
已知:CO进入血液后有如下平衡:CO+Hb·O2 O2+Hb·CO
O2+Hb·CO
①C、N、O三种元素,第一电离能由大到小的顺序为________ ,简单氢化物的沸点由大到小的顺序为_____ (用氢化物化学式表示)。
②在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是:_______________ 。
③高压氧舱可用于治疗CO中毒,结合平衡移动原理解释其原因:____________ 。
(3)为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的晶胞结构如图所示。________ 。
②已知阿伏加德罗常数的值为NA,该晶体的密度为ρg/cm3。其晶胞为立方体结构,则晶胞的边长为________ cm。
(2)CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。
已知:CO进入血液后有如下平衡:CO+Hb·O2
 O2+Hb·CO
O2+Hb·CO①C、N、O三种元素,第一电离能由大到小的顺序为
②在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是:
③高压氧舱可用于治疗CO中毒,结合平衡移动原理解释其原因:
(3)为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的晶胞结构如图所示。

②已知阿伏加德罗常数的值为NA,该晶体的密度为ρg/cm3。其晶胞为立方体结构,则晶胞的边长为
您最近一年使用:0次
2 . 碳中和的目标是减少含碳气体的排放。CH4与CO2都能引起温室效应,将二者联合处理不仅可以减缓温室气体排放,还可以转化为CH3OH、CH3COOH、H2等高附加值产品。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/mol
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol
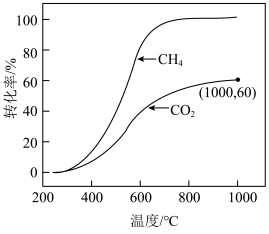
若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。_______ 下能自发进行(填“高温”或“低温”)。
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数_______ (填“增大”“减小”或“不变”)。
③1000℃时反应Ⅱ 的平衡常数K=_______ (保留3位有效数字,下同),平衡时CO的体积分数为_______ 。
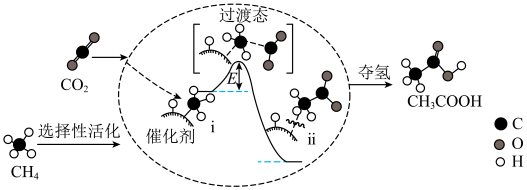
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。_______ 。
②转化过程中经历了i→ii的变化,该变化过程_______ (填“吸热”或“放热”)。产物CH3COOH中碳原子的杂化方式为_______ 。
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为_______ 。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/molⅡ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数
③1000℃时反应Ⅱ 的平衡常数K=
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。
②转化过程中经历了i→ii的变化,该变化过程
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为
您最近一年使用:0次
名校
解题方法
3 . 氟元素可形成多种有工业价值和科研价值的化合物,如OF2、(CF)x、XeF2、HF、NH4BF4、CaF2等。
(1)基态F原子核外电子有______ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填序号)。
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p2 D.1s22s22p33p2
(2)F2通入稀NaOH溶液中可生成OF2,其中氧原子的杂化方式为_________ 。
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点(192℃),其原因是___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,(CF)x的导电性________ (填“增强”或“减弱”),(CF)x中C-C键的键长比石墨中C-C键的_______ (填“长”或“短”)。

(5)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、NH4BF4及清洗剂CH3CH(OH)CH3,三种物质中除H外的各元素的电负性由大到小的顺序为________ ,1mol氟硼酸铵(NH4BF4)中含有_______ mol配位键。
(1)基态F原子核外电子有
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p2 D.1s22s22p33p2
(2)F2通入稀NaOH溶液中可生成OF2,其中氧原子的杂化方式为
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点(192℃),其原因是
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,(CF)x的导电性

(5)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、NH4BF4及清洗剂CH3CH(OH)CH3,三种物质中除H外的各元素的电负性由大到小的顺序为
您最近一年使用:0次
名校
4 . 配合物在许多方面有着广泛的应用。下列叙述不正确的是
| A.以Mg2+为中心的大环配合物叶绿素能催化光合作用 |
| B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液 |
| C.[Ag(NH3)2]+是化学镀银试剂的有效成分 |
| D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+ |
您最近一年使用:0次
名校
解题方法
5 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: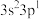 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)根据对角线规则,在周期表中,与Li化学性质最相似的邻族元素是___________ (填元素符号),MgO的电子式为___________ 。
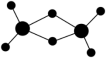
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于___________ 分子(填“极性”或“非极性”)分子,分子中Al采取___________ 杂化。
(3)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)。
(4)PH3的电子式为___________ ;NH3很容易液化(常用作冷库中的制冷剂),而同主族的PH3却没有这样的性质,原因是:___________ 。
(5)亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,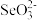 的键角小于气态分子SeO3的原因是:
的键角小于气态分子SeO3的原因是:___________ 。
(1)根据对角线规则,在周期表中,与Li化学性质最相似的邻族元素是
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于

(3)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)。
A.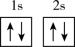 | B.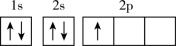 |
C.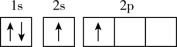 | D.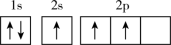 |
(5)亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,
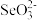 的键角小于气态分子SeO3的原因是:
的键角小于气态分子SeO3的原因是:
您最近一年使用:0次
名校
解题方法
7 . 下列化学用语描述错误的是
A.中子数为18的硫原子: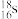 |
B.二氧化碳的空间填充模型: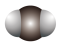 |
C.用电子云轮廓图表示H-H的s-s σ键形成的示意图: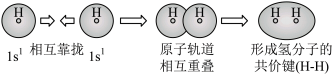 |
D.用电子式表示K2S的形成: |
您最近一年使用:0次
名校
8 . 下列化学用语表示正确的是
A. 的空间填充模型: 的空间填充模型: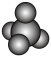 | B.聚丙烯的链节: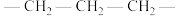 |
C.NaCl晶胞: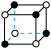 | D. 的VSEPR模型: 的VSEPR模型: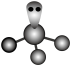 |
您最近一年使用:0次
名校
9 . 工业制取氮化硼的反应原理: 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是
| A.电负性:B>N>H |
| B.键角:NH3>BCl3 |
| C.NH3与BCl3都是非极性分子 |
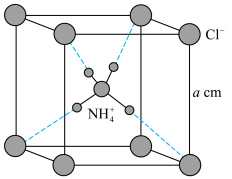
D.NH4Cl晶胞如图所示,则距离 最近的Cl-有8个 最近的Cl-有8个 |
您最近一年使用:0次
名校
解题方法
10 . 下列有关说法正确的是
| A.只含分子的晶体一定是分子晶体 |
| B.H2O的稳定性大于H2S是因为H2O分子间存在氢键 |
| C.杂化轨道只用于形成共价键 |
| D.[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道 |
您最近一年使用:0次



