1 . 光催化剂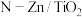 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子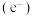 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基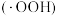 ,空穴
,空穴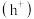 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基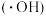 ,
, 分别与
分别与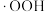 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是
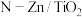 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子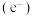 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基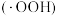 ,空穴
,空穴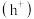 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基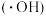 ,
, 分别与
分别与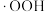 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是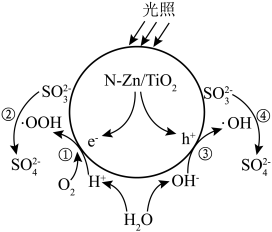
A.通过①②过程和③④过程产生的 之比为 之比为 |
B. 氧化 氧化 的反应为 的反应为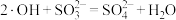 |
C. 过低或过高均会影响催化剂的催化效果 过低或过高均会影响催化剂的催化效果 |
D.氧化含硫废液的总反应为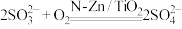 |
您最近半年使用:0次
2024-04-16更新
|
210次组卷
|
2卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
名校
解题方法
2 . 下列离子方程式书写正确的是
A.硫酸铝溶液与过量氨水反应: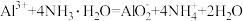 |
B.向过量的 溶液中滴加少量“84”消毒液: 溶液中滴加少量“84”消毒液: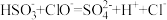 |
C.向次氯酸钠溶液中通入少量二氧化碳: |
D.向碘化亚铁溶液中通入过量氯气: |
您最近半年使用:0次
名校
解题方法
3 . 类推的思维方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证,以下类推的结论中正确的是
A. 是酸性氧化物,故 是酸性氧化物,故 也是酸性氧化物 也是酸性氧化物 |
B.稀盐酸与镁反应生成 ,故稀硝酸与镁反应也生成 ,故稀硝酸与镁反应也生成 |
| C.氯单质与水反应生成次氯酸,故溴单质与水反应生成次溴酸 |
D. 能使酸性 能使酸性 溶液褪色,故 溶液褪色,故 也能使酸性 也能使酸性 溶液褪色 溶液褪色 |
您最近半年使用:0次
4 . 宏观辨识与微观探析是化学学科核心素养之一。下列反应的离子方程式书写正确的是
A.将NH3通入稀硝酸中: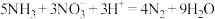 |
B.向FeCl3溶液中加入KSCN溶液: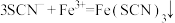 |
C.将Na2SO3溶液与酸性高锰酸钾溶液混合: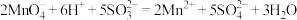 |
D.Mg(OH)2溶于NH4Cl溶液中: |
您最近半年使用:0次
名校
解题方法
5 . 为了增强大气污染防治的科学性、针对性和有效性,研究大气颗粒物的化学组成和分布特征具有很重要的意义。水溶性离子是PM2.5的重要组成部分,主要包含 、
、 、
、 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、 、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
(1)常温下,将某地大气污染物样品配制成溶液,所得溶液显______。
(2)PM2.5中的 主要源自燃煤产生的
主要源自燃煤产生的 ,写出SO2转化为H2SO4的化学方程式
,写出SO2转化为H2SO4的化学方程式______ 、______ 。
 、
、 、
、 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、 、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:(1)常温下,将某地大气污染物样品配制成溶液,所得溶液显______。
| A.酸性 | B.碱性 | C.中性 | D.无法判断 |
 主要源自燃煤产生的
主要源自燃煤产生的 ,写出SO2转化为H2SO4的化学方程式
,写出SO2转化为H2SO4的化学方程式
您最近半年使用:0次
6 . Fe3S4固体是一种重要的磁性材料,以它为原料实现如下化合物的转化: 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。
请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为___________ ,无色酸性溶液F中的含硫阴离子有___________ 。
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4)写出F→G反应的化学方程式___________ 。请设计实验方案确定溶液G中的阴离子___________ 。

 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式
(3)下列说法正确的是___________。
| A.固体A中可能含有FeO | B.无色气体E能完全溶于水 |
| C.溶液C呈酸性,是由于Fe3+水解 | D.溶液B可溶解铜 |
(4)写出F→G反应的化学方程式
您最近半年使用:0次
7 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
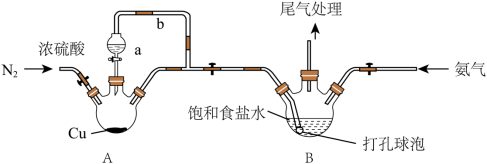
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称_______ ,导气管b的作用_______ 。
(2)装置A中发生的化学反应的化学方程式为_______ 。
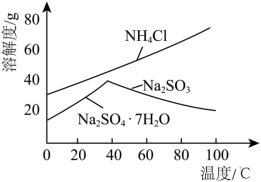
(3)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得(写化学式)_______ ,然后将滤液_______ 、过滤、洗涤、干燥可得另一产物,检验此产物中所含阳离子的主要操作是:________________ 。
(4)产品中可能混有少量 和
和 杂质,加热前,需通入足量N2,可以有效减少
杂质,加热前,需通入足量N2,可以有效减少 杂质的产生,通N2的作用是
杂质的产生,通N2的作用是_______ 。
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称
(2)装置A中发生的化学反应的化学方程式为
(3)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得(写化学式)

(4)产品中可能混有少量
 和
和 杂质,加热前,需通入足量N2,可以有效减少
杂质,加热前,需通入足量N2,可以有效减少 杂质的产生,通N2的作用是
杂质的产生,通N2的作用是
您最近半年使用:0次
名校
8 . 下表是某城市某日空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是____________________ 。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成________ 色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_____________ ,写出反应的化学方程式________________ 。
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)________ 。
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作________________ 。
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式_____________ 。
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | Ⅱ | 良 |
实验一:用下图所示装置进行实验。

(1)A装置的作用是
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成
(3)D装置的作用是
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式
您最近半年使用:0次
9 . 能正确表示下列反应的离子方程式为
A.过量铁粉加入稀硝酸中:Fe+4H++NO =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
| B.氯化铜溶液中通入硫化氢:Cu2++S2-=CuS↓ |
C.用Na2SO3溶液吸收少量Cl2:3SO +Cl2+H2O=2HSO +Cl2+H2O=2HSO +2Cl-+SO +2Cl-+SO |
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH +OH-=NH3•H2O +OH-=NH3•H2O |
您最近半年使用:0次
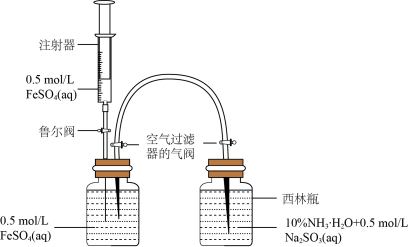
10 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在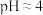 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且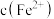 降低量大于
降低量大于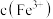 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
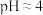 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且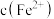 降低量大于
降低量大于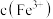 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 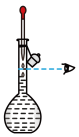 | 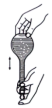 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近半年使用:0次



