名校
解题方法
1 . 有机物 有良好的黏痰溶解作用及润滑呼吸道作用,其合成路线如图(部分反应条件及产物已略):
有良好的黏痰溶解作用及润滑呼吸道作用,其合成路线如图(部分反应条件及产物已略):___________ 。
(2)D中官能团的名称为___________ 。
(3)②的反应类型是___________ 。
(4) 是B的芳香族同分异构体(含苯环),满足下列条件的
是B的芳香族同分异构体(含苯环),满足下列条件的 有
有___________ 种;其中核磁共振氢谱有4组吸收峰且峰面积之比为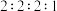 的
的 的结构简式为
的结构简式为___________ 。
①可水解;
②可与新制 反应;
反应;
③ 最多消耗
最多消耗 。
。
(5)可用银氨溶液检验C中的特征官能团,写出该反应的化学方程式:___________ 。
(6)下列关于 的说法正确的是___________。
的说法正确的是___________。
(7)参照 的合成路线图,写出以
的合成路线图,写出以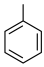 和
和 为原料制备
为原料制备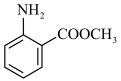 的合成路线
的合成路线___________ (无机试剂任选)。
 有良好的黏痰溶解作用及润滑呼吸道作用,其合成路线如图(部分反应条件及产物已略):
有良好的黏痰溶解作用及润滑呼吸道作用,其合成路线如图(部分反应条件及产物已略):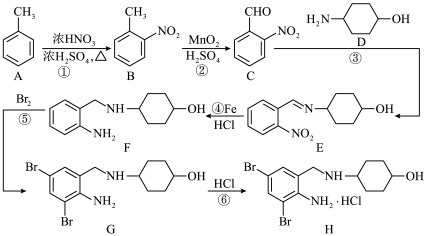
(2)D中官能团的名称为
(3)②的反应类型是
(4)
 是B的芳香族同分异构体(含苯环),满足下列条件的
是B的芳香族同分异构体(含苯环),满足下列条件的 有
有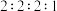 的
的 的结构简式为
的结构简式为①可水解;
②可与新制
 反应;
反应;③
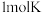 最多消耗
最多消耗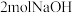 。
。(5)可用银氨溶液检验C中的特征官能团,写出该反应的化学方程式:
(6)下列关于
 的说法正确的是___________。
的说法正确的是___________。| A.难溶于水 | B.可使酸性 溶液褪色 溶液褪色 |
C.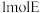 最多与 最多与 加成 加成 | D.不能与金属钠反应 |
(7)参照
 的合成路线图,写出以
的合成路线图,写出以 和
和 为原料制备
为原料制备 的合成路线
的合成路线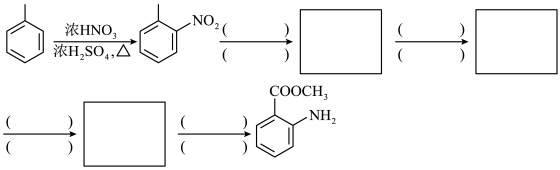
您最近一年使用:0次
名校
2 . L是一种治疗自主神经功能障碍药物的活性成分,以A为原料合成L的流程如图所示。
(1)下列说法正确的是___________。
(2)E的结构简式为___________ 。
(3)H→I第一步反应的化学方程式为___________ 。
(4)设计F→G,H→I步骤的目的是___________ 。
(5)G→H中 可以用吡啶(
可以用吡啶(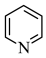 )替代,吡啶的作用是
)替代,吡啶的作用是___________ 。
(6)在E的芳香族同分异构体中,同时具备下列条件的结构有___________ 种。
①既能发生水解反应,又能发生银镜反应;
②1mol有机物最多能与3molNaOH反应;
③1mol有机物与足量的Na反应能生成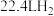 (标准状况)。
(标准状况)。
(7)设计以苯乙醛为原料制备吸湿性高分子材料(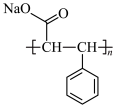 )的合成路线
)的合成路线___________ (无机试剂任选)。

(1)下列说法正确的是___________。
| A.A的名称是3-甲基苯酚 | B.B、C中均无手性碳原子 |
| C.H中官能团有酯基、醚键 | D.J→L为取代反应 |
(2)E的结构简式为
(3)H→I第一步反应的化学方程式为
(4)设计F→G,H→I步骤的目的是
(5)G→H中
 可以用吡啶(
可以用吡啶( )替代,吡啶的作用是
)替代,吡啶的作用是(6)在E的芳香族同分异构体中,同时具备下列条件的结构有
①既能发生水解反应,又能发生银镜反应;
②1mol有机物最多能与3molNaOH反应;
③1mol有机物与足量的Na反应能生成
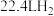 (标准状况)。
(标准状况)。(7)设计以苯乙醛为原料制备吸湿性高分子材料(
 )的合成路线
)的合成路线
您最近一年使用:0次
2024-06-10更新
|
379次组卷
|
4卷引用:2024届天津市天津市河西区天津市第四中学模拟预测化学试题
名校
解题方法
3 . 工业上使用 溶液可将
溶液可将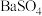 转化为
转化为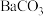 ,一定温度下
,一定温度下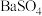 和
和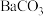 的沉淀溶解平衡曲线如图所示。已知
的沉淀溶解平衡曲线如图所示。已知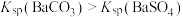 ,处理过程中忽略溶液体积的变化,
,处理过程中忽略溶液体积的变化,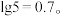
 溶液可将
溶液可将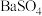 转化为
转化为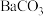 ,一定温度下
,一定温度下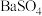 和
和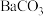 的沉淀溶解平衡曲线如图所示。已知
的沉淀溶解平衡曲线如图所示。已知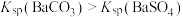 ,处理过程中忽略溶液体积的变化,
,处理过程中忽略溶液体积的变化,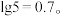
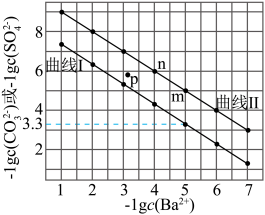
A.曲线I为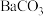 的沉淀溶解平衡曲线, 的沉淀溶解平衡曲线, 的数量级是 的数量级是 |
B.向 点饱和溶液中加适量 点饱和溶液中加适量 固体,可使溶液由 固体,可使溶液由 点变到 点变到 点 点 |
C.p点条件下,能生成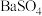 沉淀,不能生成 沉淀,不能生成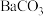 沉淀 沉淀 |
D.用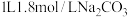 处理 处理 ,处理5次可使 ,处理5次可使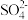 全进入溶液 全进入溶液 |
您最近一年使用:0次
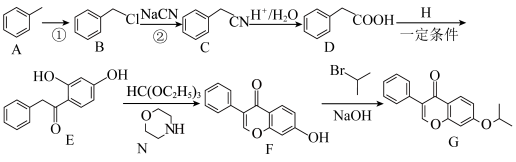
4 . 化合物G俗称依普黄酮,是一种抗骨质疏松药物的主要成分。以甲苯为原料合成该化合物的路线如下图所示:___________ 。
(2)H的名称为___________ 。
(3)G中含氧官能团的名称为___________ ,反应B→C的反应类型为___________ 。
(4)F与足量的 完全加成后所生成的化合物中手性碳原子的个数为
完全加成后所生成的化合物中手性碳原子的个数为___________ 。
(5)N的同分异构体中既能发生银镜反应又能发生水解反应的共有___________ 种。请写出其中核磁共振氢谱有五组峰的有机物在加热条件下,和足量的盐酸发生水解反应的化学方程式:___________ 。
(6)根据上述信息,设计以苯酚和为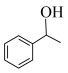 原料,制备
原料,制备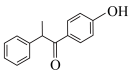 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)___________ 。
已知: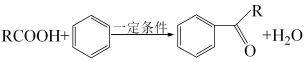
(2)H的名称为
(3)G中含氧官能团的名称为
(4)F与足量的
 完全加成后所生成的化合物中手性碳原子的个数为
完全加成后所生成的化合物中手性碳原子的个数为(5)N的同分异构体中既能发生银镜反应又能发生水解反应的共有
(6)根据上述信息,设计以苯酚和为
 原料,制备
原料,制备 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
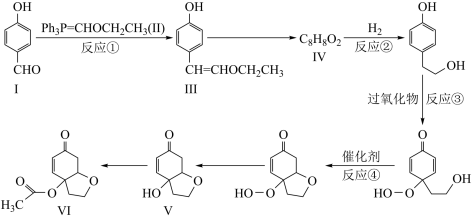
5 . 天然产物V具有抗疟活性,某研究小组以化合物Ⅰ为原料合成Ⅴ及其衍生物Ⅵ的路线如下(部分反应条件省略,Ph表示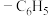 ):
):______ ,化合物Ⅲ中含氧官能团有______ (写名称)。
(2)反应①的方程式可表示为:Ⅰ+Ⅱ=Ⅲ+Z,化合物Z的分子式为______ 。
(3)化合物Ⅳ能发生银镜反应,写出其结构简式______ 。
(4)反应②的反应类型是______ ,反应③的反应类型是______ 。
(5)化合物Ⅵ的芳香族同分异构体中,同时满足如下条件的有______ 种,写出其中任意一种的结构简式______ 。
条件:a.能与NaHCO3反应;b.最多能与2倍物质的量的NaOH反应;c.能与3倍物质的量的Na发生放出H2的反应;d.核磁共振氢谱确定分子中有7个化学环境相同的氢原子;ę.不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(6)已知: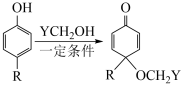 ,根据上述信息,写出以苯酚的一种同系物及
,根据上述信息,写出以苯酚的一种同系物及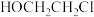 为原料合成
为原料合成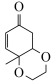 的路线
的路线______ (不需注明反应条件)。
 ):
):
(2)反应①的方程式可表示为:Ⅰ+Ⅱ=Ⅲ+Z,化合物Z的分子式为
(3)化合物Ⅳ能发生银镜反应,写出其结构简式
(4)反应②的反应类型是
(5)化合物Ⅵ的芳香族同分异构体中,同时满足如下条件的有
条件:a.能与NaHCO3反应;b.最多能与2倍物质的量的NaOH反应;c.能与3倍物质的量的Na发生放出H2的反应;d.核磁共振氢谱确定分子中有7个化学环境相同的氢原子;ę.不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(6)已知:
 ,根据上述信息,写出以苯酚的一种同系物及
,根据上述信息,写出以苯酚的一种同系物及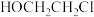 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
名校
解题方法
6 . 越王勾践剑是春秋晚期越国青铜器,此剑历经两千四百余年,仍锋利无比。经无损科学检测,其主要合金成分为铜、锡、铅、铁、硫,还含有少量的铝和微量的镍等。2017年,我国宣布成功完成性能优异的超级钢研制。这种超级钢造价低廉、具有优异的强度和延展性,其合金元素为锰、碳、铝、钒等。
(1)碳、锡(Sn)和铅均属___________ 族元素,其中锡的核电荷数比碳大44,则基态锡原子简化的核外电子排布式为___________ ,三者的原子半径依次递增,请解释原因___________ 。
(2)基态锰原子的价层电子轨道表示式为___________ 。
(3)硫代硫酸根离子可看作是硫酸根离子中的一个氧原子被硫原子取代的产物,则硫代硫酸根离子的空间构型是___________ ,硫代硫酸根离子作为配体可提供孤电子对与 形成
形成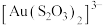 ,请判断硫代硫酸根离子中的两种硫原子
,请判断硫代硫酸根离子中的两种硫原子___________ (选填“中心硫原子”、“端基硫原子”、“均”)可以做配位原子。
(4)气态 通常以二聚体
通常以二聚体 的形式存在,
的形式存在, 气体中存在的作用力包含以下的
气体中存在的作用力包含以下的___________ (选填字母)。
a.离子键 b.配位键 c.π键 d.p-p σ键 e. -p σ键
-p σ键
(5) 的熔点为1090℃,远高于氯化铝的192℃,则
的熔点为1090℃,远高于氯化铝的192℃,则 的晶体类型为
的晶体类型为___________ 。
(6) 是一种常见催化剂,其晶胞结构如图,晶胞中黑球为
是一种常见催化剂,其晶胞结构如图,晶胞中黑球为___________ 原子(用元素符号表示)。
(1)碳、锡(Sn)和铅均属
(2)基态锰原子的价层电子轨道表示式为
(3)硫代硫酸根离子可看作是硫酸根离子中的一个氧原子被硫原子取代的产物,则硫代硫酸根离子的空间构型是
 形成
形成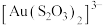 ,请判断硫代硫酸根离子中的两种硫原子
,请判断硫代硫酸根离子中的两种硫原子(4)气态
 通常以二聚体
通常以二聚体 的形式存在,
的形式存在, 气体中存在的作用力包含以下的
气体中存在的作用力包含以下的a.离子键 b.配位键 c.π键 d.p-p σ键 e.
 -p σ键
-p σ键(5)
 的熔点为1090℃,远高于氯化铝的192℃,则
的熔点为1090℃,远高于氯化铝的192℃,则 的晶体类型为
的晶体类型为(6)
 是一种常见催化剂,其晶胞结构如图,晶胞中黑球为
是一种常见催化剂,其晶胞结构如图,晶胞中黑球为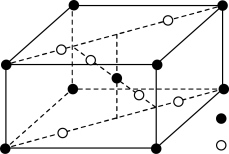
您最近一年使用:0次
7 . 1,6-己二醇是精细化工领域的一种重要原料,广泛应用于UV涂料、聚氨酯、环氧树脂、增塑剂等领域。己二酸二甲酯(DMA)直接加氢制备1,6-己二醇工艺的副产物少、三废少,且产品纯度较高。其制备原理为:
(1)已知
计算上述反应的
___________  。
。
(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的___________ (填标号)。
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是___________ 。
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=___________ 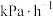 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=___________ 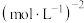 (列出计算式即可)。
(列出计算式即可)。
(4)用 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,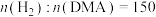 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
___________  (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是___________ 。 ]合成。
]合成。 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。___________ 。
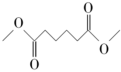 (g)+4H2(g)
(g)+4H2(g)
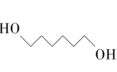 (g)+2CH3OH(g) ∆H
(g)+2CH3OH(g) ∆H
(1)已知
| 化学键 | C=O | C—O | C—H | C—C | O—H | H—H |
键能/ | 745 | a | 413 | b | 467 | 436 |

 。
。(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol
 ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=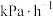 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=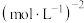 (列出计算式即可)。
(列出计算式即可)。(4)用
 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,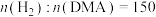 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
 (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
 ]合成。
]合成。 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。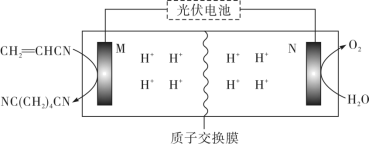
您最近一年使用:0次
2024-05-27更新
|
205次组卷
|
2卷引用:天津市耀华中学2024届高三下学期第二次模拟化学试题
解题方法
8 . 化合物 (奥司他韦)是目前治疗流感的最常用药物之一,其合成路线如图:
(奥司他韦)是目前治疗流感的最常用药物之一,其合成路线如图: 的核磁共振氢谱有
的核磁共振氢谱有___________ 组峰; 的反应类型是
的反应类型是___________ ;
(2)A的结构简式为___________ ;  中官能团的名称为
中官能团的名称为___________ ;C的化学名称为___________ ;
(3)反应 的化学方程式为
的化学方程式为___________ ;
(4)在B的同分异构体中,同时满足下列条件的共有___________ 种(不考虑立体异构)。
①含有-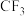 的链状结构;②能与饱和
的链状结构;②能与饱和 溶液反应产生气体。
溶液反应产生气体。
其中核磁共振氢谱显示为4组峰,且峰面积比为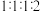 的同分异构体的结构简式为
的同分异构体的结构简式为___________ 。(写出一种即可)
(5)二碳酸二叔丁酯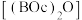 是普遍使用的氨基保护剂,可以用
是普遍使用的氨基保护剂,可以用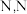 -二甲基乙二胺(
-二甲基乙二胺(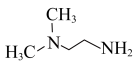 )除去反应体系中过量的
)除去反应体系中过量的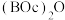 。根据信息,判断并写出制备
。根据信息,判断并写出制备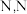 -二甲基乙二胺时中间产物
-二甲基乙二胺时中间产物 、
、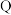 的结构简式:
的结构简式:
___________ 、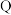
___________ 。
 (奥司他韦)是目前治疗流感的最常用药物之一,其合成路线如图:
(奥司他韦)是目前治疗流感的最常用药物之一,其合成路线如图:
已知: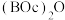 的结构简式为
的结构简式为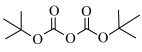 。回答下列问题:
。回答下列问题:
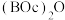 的核磁共振氢谱有
的核磁共振氢谱有 的反应类型是
的反应类型是(2)A的结构简式为
 中官能团的名称为
中官能团的名称为(3)反应
 的化学方程式为
的化学方程式为(4)在B的同分异构体中,同时满足下列条件的共有
①含有-
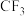 的链状结构;②能与饱和
的链状结构;②能与饱和 溶液反应产生气体。
溶液反应产生气体。其中核磁共振氢谱显示为4组峰,且峰面积比为
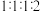 的同分异构体的结构简式为
的同分异构体的结构简式为(5)二碳酸二叔丁酯
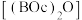 是普遍使用的氨基保护剂,可以用
是普遍使用的氨基保护剂,可以用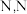 -二甲基乙二胺(
-二甲基乙二胺( )除去反应体系中过量的
)除去反应体系中过量的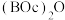 。根据信息,判断并写出制备
。根据信息,判断并写出制备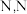 -二甲基乙二胺时中间产物
-二甲基乙二胺时中间产物 、
、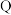 的结构简式:
的结构简式:
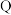
您最近一年使用:0次
9 . 亚硝酸钠( )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。
(1)滴入浓硝酸前先通入一段时间的 ,目的是
,目的是___________ 。
(2)B中发生反应的化学方程式为___________ 、___________ 。
(3)C中试剂是___________ (填名称)。
(4)装置E的作用是___________ 。
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:___________ 。
(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ. 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ. 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: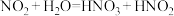 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。
ⅲ. 离子颜色为绿色。
离子颜色为绿色。
猜想1: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想2: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,溶液呈黄色,加入
,溶液呈黄色,加入___________ (填化学式)后呈绿色,证实猜想1合理。
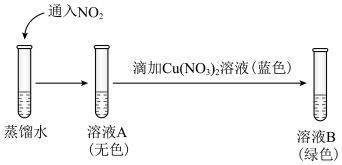
②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
 )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。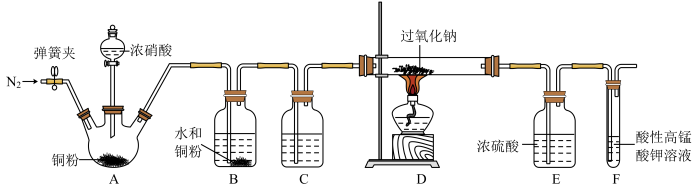
(1)滴入浓硝酸前先通入一段时间的
 ,目的是
,目的是(2)B中发生反应的化学方程式为
(3)C中试剂是
(4)装置E的作用是
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是
 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ.
 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;ⅱ.
 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: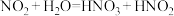 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。ⅲ.
 离子颜色为绿色。
离子颜色为绿色。猜想1:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想2:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,溶液呈黄色,加入
,溶液呈黄色,加入②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。
 的证据是
的证据是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
10 . CO2的资源化利用具有重要的意义。合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现:
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为_______ ;该反应自发进行的条件是_______ (填“低温”、“高温”或“任意条件“”)。
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是_______ 。
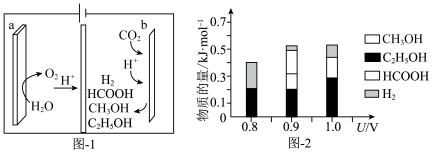
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。_______ 。
②控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
反应2:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol
恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。_______ (写出计算式即可)。
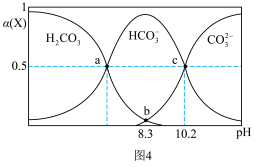
(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=_______ 。
2NH3(g)+CO2(g)=NH2COONH4(s) △H1=-272kJ/mol
NH2COONH4(s)=CO(NH2)2(l)+H2O(g) △H2=+138kJ/mol
(1)二氧化碳和氨气合成尿素和水蒸气的热化学方程式为
(2)MgO是CO2和环氧乙烷合成碳酸乙烯酯的催化剂,可由MgCl2与沉淀剂(尿素、氢氧化钠)反应,先生成沉淀,过滤后将沉淀焙烧得到。已知向MgCl2溶液中加入尿素生成的是Mg5(CO3)4(OH)2沉淀,与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的MgO作催化剂效果更好,其原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
②控制电压为0.8V,电解时转移电子的物质的量为
CH4与CO2重整主要发生下列反应:
反应1:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol反应2:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41kJ/mol
H2O(g)+CO(g) △H=+41kJ/mol恒温,将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2。
(4)下列说法正确的是_______。
| A.n(CO)保持不变说明容器已经达到平衡状态 |
| B.容器中气体密度不变能说明反应已经达到平衡状态 |
| C.恒容向容器中充入He,CH4平衡转化率变小 |
| D.如果将容器体积缩小为1L,则反应1的化学反应速率变快,反应2不变 |
(5)CH4和CO2的平衡转化率随温度变化关系如图3所示。

(6)室温下,H2CO3溶液中各含碳微粒的物质的量分数与pH的关系如图4所示。则H2CO3的Ka1=
您最近一年使用:0次



