名校
解题方法
1 . 硅材料在生活中占有重要地位。请回答:
(1)Si位于元素周期表的位置:___________ 。基态Si原子核外电子共具有___________ 种不同的能量,其中电子占据最高能级的电子云轮廓图为___________ 。
(2)工业制备粗硅的化学方程式为:___________ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:①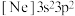 、②
、②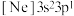 、③
、③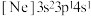 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(4)Si与P形成的某化合物晶体的晶胞为立方体,边长为a nm,结构如下图。该晶体类型是___________ ,已知该化合物的最简式的式量为Mr,则该晶体密度为___________ g/cm3。(列出算式,已知 为阿伏加德罗常数的数值)
为阿伏加德罗常数的数值) 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为___________ ,Si与O的原子数之比为___________ 。
(1)Si位于元素周期表的位置:
(2)工业制备粗硅的化学方程式为:
(3)由硅原子核形成的三种微粒,电子排布式分别为:①
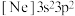 、②
、②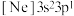 、③
、③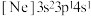 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(4)Si与P形成的某化合物晶体的晶胞为立方体,边长为a nm,结构如下图。该晶体类型是
 为阿伏加德罗常数的数值)
为阿伏加德罗常数的数值)
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
您最近一年使用:0次
解题方法
2 . 常温下,二元弱酸 在溶液中各组分百分含量
在溶液中各组分百分含量 随溶液pH的变化如图所示。下列说法错误的是
随溶液pH的变化如图所示。下列说法错误的是
 在溶液中各组分百分含量
在溶液中各组分百分含量 随溶液pH的变化如图所示。下列说法错误的是
随溶液pH的变化如图所示。下列说法错误的是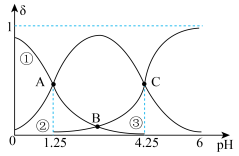
A.曲线②表示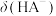 随溶液pH的变化 随溶液pH的变化 |
B. 的一级电离常数 的一级电离常数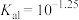 |
C.NaHA溶液中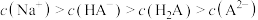 |
D.常温下,若向 溶液中滴加 溶液中滴加 溶液使溶液pH=7,则一定存在: 溶液使溶液pH=7,则一定存在: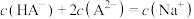 |
您最近一年使用:0次
2024-02-25更新
|
728次组卷
|
7卷引用:天津市红桥区2024届高三下学期二模化学试题
天津市红桥区2024届高三下学期二模化学试题2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学甘肃省白银市名校2023-2024学年高三下学期联合调研化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)甘肃省天水市麦积区2024届高三下学期2月第二次模拟检测化学试题2024届陕西省西安博爱国际学校高三下学期第一次模拟考试理科综合试卷-高中化学四川省成都市崇州市怀远中学2023-2024学年高三上学期期末理综试题-高中化学
名校
解题方法
3 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原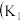 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: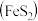 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
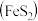 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
786次组卷
|
5卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题安徽省合肥市第一中学2023-2024学年高一下学期月考化学试题(一)广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题河南省三门峡市渑池县第二高级中学2023-2024学年高一下学期4月期中考试化学试题
4 . 锰和硫能形成多种重要的化合物,在工业生产中有广泛应用。回答下列问题:
(1)烟气中的SO2可与CO进行综合处理。
已知:Ⅰ.S(g)+O2(g)=SO2(g) ΔH=-297.3kJ·mol-1
Ⅱ.CO的燃烧热283kJ·mol-1
Ⅲ.相关化学键的键能数据如表所示:
①表中x=___________ 。
②写出CO的燃烧热的热化学方程式:___________ 。
③以物质的量之比为1﹕2的SO2和CO充入密闭容器中发生反应SO2(g)+2CO(g) S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为___________ (填“L1”或“L2”),T0℃时该反应的平衡常数K=___________ 。

(2)Na2S2O8具有强氧化性,其中的S元素为+6价,Na2S2O8用于检验水相中的Mn2+时,生成SO 且溶液变为紫红色,1molNa2S2O8中过氧键的数目为
且溶液变为紫红色,1molNa2S2O8中过氧键的数目为___________ ;检验Mn2+的反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)MnO2可用如图装置电解方法制备,电解池中间是质子交换膜,分隔开的两室溶液分别为足量的硫酸钠溶液和足量的硫酸锰溶液,则阴极室中的溶液为___________ ;电解产生的MnO2沉积在电极上,若一段时间后该电极所在的溶液质量减轻了4.45g,则电路中转移电子的物质的量为___________ mol。

(1)烟气中的SO2可与CO进行综合处理。
已知:Ⅰ.S(g)+O2(g)=SO2(g) ΔH=-297.3kJ·mol-1
Ⅱ.CO的燃烧热283kJ·mol-1
Ⅲ.相关化学键的键能数据如表所示:
| 化学键 | C O O | C=O | O=O |
| 键能(E)/kJ·mol-1 | 1076 | x | 498 |
②写出CO的燃烧热的热化学方程式:
③以物质的量之比为1﹕2的SO2和CO充入密闭容器中发生反应SO2(g)+2CO(g)
 S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
(2)Na2S2O8具有强氧化性,其中的S元素为+6价,Na2S2O8用于检验水相中的Mn2+时,生成SO
 且溶液变为紫红色,1molNa2S2O8中过氧键的数目为
且溶液变为紫红色,1molNa2S2O8中过氧键的数目为(3)MnO2可用如图装置电解方法制备,电解池中间是质子交换膜,分隔开的两室溶液分别为足量的硫酸钠溶液和足量的硫酸锰溶液,则阴极室中的溶液为

您最近一年使用:0次
名校
解题方法
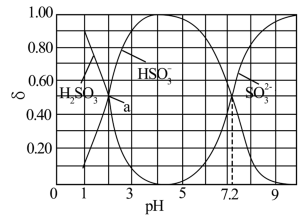
5 . 边搅拌边向 溶液中通入
溶液中通入 制备
制备 溶液,水溶液中
溶液,水溶液中 、
、 、
、 的分布系数δ随pH的变化关系如图所示。[比如
的分布系数δ随pH的变化关系如图所示。[比如 的分布系数:
的分布系数: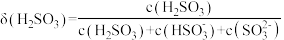 ]下列有关叙述错误的是
]下列有关叙述错误的是
 溶液中通入
溶液中通入 制备
制备 溶液,水溶液中
溶液,水溶液中 、
、 、
、 的分布系数δ随pH的变化关系如图所示。[比如
的分布系数δ随pH的变化关系如图所示。[比如 的分布系数:
的分布系数: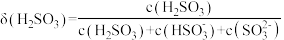 ]下列有关叙述错误的是
]下列有关叙述错误的是
| A.当溶液pH范围为4~5时,停止通入SO2 |
B.根据曲线数据计算可知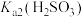 的数量级为 的数量级为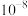 |
C.a点的溶液中 |
D. 的溶液中, 的溶液中,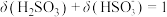 |
您最近一年使用:0次
名校
6 . 如图所示与对应叙述相符的是
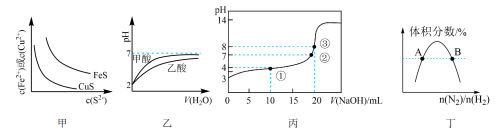

A.图甲:一定温度 、 、 沉淀溶解平衡曲线,则 沉淀溶解平衡曲线,则 |
B.图乙:等体积 的甲酸与乙酸稀释的 的甲酸与乙酸稀释的 曲线,则酸性:甲酸 曲线,则酸性:甲酸 乙酸 乙酸 |
C.图丙:某温度下向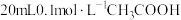 溶液中逐滴加入 溶液中逐滴加入 溶液, 溶液, 变化曲线如图丙所示(忽略温度变化),则①点 变化曲线如图丙所示(忽略温度变化),则①点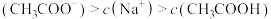 |
D.图丁: 平衡时 平衡时 体积分数随起始 体积分数随起始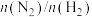 变化曲线,则转化率: 变化曲线,则转化率: |
您最近一年使用:0次
名校
7 . 完成下列小题
(1)现有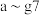 种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
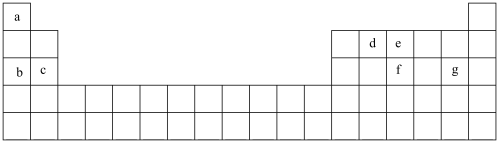
①元素 和f在周期表中的位置
和f在周期表中的位置_____ ,_____ 。
②用电子式表示由 与
与 元素组成化合物的形成过程:
元素组成化合物的形成过程:_____ 。
③元素的原子间反应最容易形成离子键的是_____ 。
A.c和f B.b和g C.d和g D.b和
④ 与
与 元素形成的分子中所有原子
元素形成的分子中所有原子_____ (填“是”或“不是”)都满足最外层为8电子结构
(2) 和
和 代表原子序数依次增大的四种短周期元素,它们满足以下条件:
代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中, 与
与 相邻,
相邻, 与
与 也相邻;②
也相邻;② 、
、 和
和 三种元素的原子最外层电子数之和为17.请填空:
三种元素的原子最外层电子数之和为17.请填空:
①下列元素的符号:
_____ 、
_____ 、
_____ 。
② 和
和 可组成一化合物,其原子个数之比为
可组成一化合物,其原子个数之比为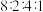 。写出该化合物的化学式
。写出该化合物的化学式_____ 。
(1)现有
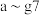 种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
①元素
 和f在周期表中的位置
和f在周期表中的位置②用电子式表示由
 与
与 元素组成化合物的形成过程:
元素组成化合物的形成过程:③元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和

④
 与
与 元素形成的分子中所有原子
元素形成的分子中所有原子(2)
 和
和 代表原子序数依次增大的四种短周期元素,它们满足以下条件:
代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,
 与
与 相邻,
相邻, 与
与 也相邻;②
也相邻;② 、
、 和
和 三种元素的原子最外层电子数之和为17.请填空:
三种元素的原子最外层电子数之和为17.请填空:①下列元素的符号:



②
 和
和 可组成一化合物,其原子个数之比为
可组成一化合物,其原子个数之比为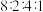 。写出该化合物的化学式
。写出该化合物的化学式
您最近一年使用:0次
名校
解题方法
8 . 为确定 和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入
和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入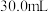 某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
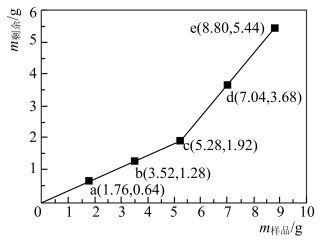
 和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入
和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入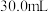 某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
A.稀硫酸中溶质的浓度为 |
B.该混合物中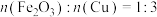 |
C.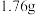 样品充分反应后,溶液中一定存在 样品充分反应后,溶液中一定存在 和 和 ,一定不存在 ,一定不存在 |
D.各组样品均发生反应: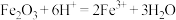 、 、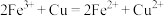 |
您最近一年使用:0次
2024-02-14更新
|
269次组卷
|
2卷引用:天津市第一中学2023-2024学年高一上学期期末考试化学试卷
名校
9 . 化合物G是一种治疗中度高血压药物的中间体,其一种合成路线如图所示(部分反应条件已略去):
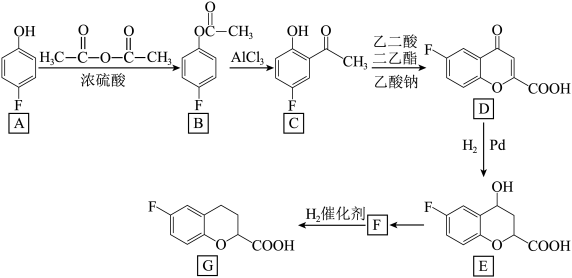
(1)A的名称为___________ ,由A生成B的反应类型为___________ 。
(2)C中含氧官能团的名称为___________ ,写出乙二酸二乙酯的结构简式:___________ 。
(3)B分子中共面原子数最多为___________ 个。
(4)由E生成F反应化学方程式为___________ 。
(5)能与NaHCO3溶液反应生成CO2,且属于芳香化合物的C的同分异构体有___________ 种
(不含立体异构),其中核磁共振氢谱中只有4组峰的结构简式为___________ 。
(6)参照上述合成路线,写出以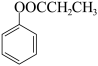 为原料制备
为原料制备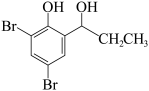 的合成路线:
的合成路线:________ (其他无机试剂任选)。

(1)A的名称为
(2)C中含氧官能团的名称为
(3)B分子中共面原子数最多为
(4)由E生成F反应化学方程式为
(5)能与NaHCO3溶液反应生成CO2,且属于芳香化合物的C的同分异构体有
(不含立体异构),其中核磁共振氢谱中只有4组峰的结构简式为
(6)参照上述合成路线,写出以
 为原料制备
为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
名校
解题方法
10 . 如图是元素周期表的一部分:
(1)写出①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。
(2)基态锑(Sb)原子的价电子排布式为___________ ;[H2F]+[SbF6]-(氟酸锑)是一种超强酸,[H2F]+离子的空间构型为___________ 。
(3)下列说法正确的是___________
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因___________ 。
(5)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是___________ 。
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________ pm(列式即可)。

| N | |||
| P | |||
| ① | |||
| Sb |
(2)基态锑(Sb)原子的价电子排布式为
(3)下列说法正确的是
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因
| 物质 | GaN | GaP |
| 熔点/℃ | 1700 | 1480 |
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为

您最近一年使用:0次



