1 . 由水电离出 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是
 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
名校
解题方法
2 .  、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:
(1)钕(Nd)属于镧系元素,则其在元素周期表中处于___________ 区, 的价电子排布图为
的价电子排布图为___________ 。
(2) 的立体构型为
的立体构型为___________ ;F原子核外有___________ 种不同空间运动状态的电子。
(3) 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为___________ 。该物质中是否存在配位键___________ (填“是”或“否”)。
(4) 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。___________ 。
②该晶体密度为 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为___________ pm。
(5) 的制备:称取研细的
的制备:称取研细的 和
和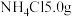 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式___________ 。若上述实验过程中得到 ,则其中所含的
,则其中所含的 键数目为
键数目为___________ 。
(6)已知某温度下 的电离平衡常数:
的电离平衡常数: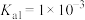 、
、 ,
,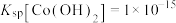 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:___________ 。
 、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:(1)钕(Nd)属于镧系元素,则其在元素周期表中处于
 的价电子排布图为
的价电子排布图为(2)
 的立体构型为
的立体构型为(3)
 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为(4)
 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。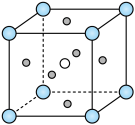
②该晶体密度为
 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为(5)
 的制备:称取研细的
的制备:称取研细的 和
和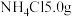 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式 ,则其中所含的
,则其中所含的 键数目为
键数目为(6)已知某温度下
 的电离平衡常数:
的电离平衡常数: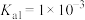 、
、 ,
,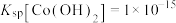 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:
您最近一年使用:0次
3 . 二氧化钒( )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(
的氧钒( )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为___________ 。只用浓盐酸与 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是___________ 。
(2)步骤ii可用如图仪器组装完成。___________ (用各接口字母表示)。
②B装置的作用是___________ 。
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是___________ ,用无水乙醇洗涤的目的是___________ 。
(3)测定氧钒( )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: 。
。
① 溶液的作用是
溶液的作用是___________ 。
②粗产品中钒的质量分数的表达式为___________ 。
 )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(
的氧钒( )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成
 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是(2)步骤ii可用如图仪器组装完成。
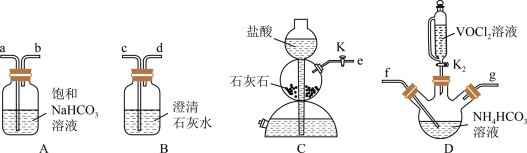
②B装置的作用是
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和
 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是(3)测定氧钒(
 )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L
 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: 。
。①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数的表达式为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
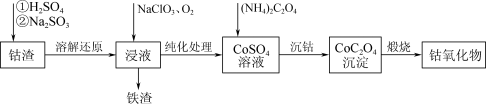
4 . Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如下:
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为_______ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是_______ 。
(3)检验CoC2O4固体是否洗净的实验操作是_______ 。
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数_______ (写出计算过程)。
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,_______ 。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是
(3)检验CoC2O4固体是否洗净的实验操作是
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗FeSO4标准溶液体积/mL | 18.32 | 18.02 | 17.98 |
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
您最近一年使用:0次
5 . 黄酮哌酯是一种解痉药,可通过如图路线合成:
(1)A→B的反应类型为___________ 。黄酮哌酯中含氧官能团的名称为___________ 。
(2)C的化学名称为___________ ,D的结构简式为___________ 。
(3)写出G的分子式___________ ,E和F可用___________ (写出试剂)鉴别。
(4)已知磺酸为一元强酸,则由A→B→C的过程制得粗苯酚中还含有比较多的苯和苯磺酸,请简述如何通过化学方法提纯苯酚___________ 。
(5)已知苯甲酸酐的结构简式为 ,写出F→G的反应方程式
,写出F→G的反应方程式___________ 。
(6)X是F的同分异构体,符合下列条件,X可能的结构简式为___________ (任写一种)。
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(7)已知:
 +CO2,设计以
+CO2,设计以 为原料合成
为原料合成 的路线
的路线___________ (其他试剂任选)。

(1)A→B的反应类型为
(2)C的化学名称为
(3)写出G的分子式
(4)已知磺酸为一元强酸,则由A→B→C的过程制得粗苯酚中还含有比较多的苯和苯磺酸,请简述如何通过化学方法提纯苯酚
(5)已知苯甲酸酐的结构简式为
 ,写出F→G的反应方程式
,写出F→G的反应方程式(6)X是F的同分异构体,符合下列条件,X可能的结构简式为
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(7)已知:

 +CO2,设计以
+CO2,设计以 为原料合成
为原料合成 的路线
的路线


您最近一年使用:0次
6 . 有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
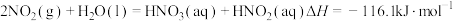
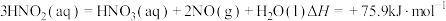
反应 的
的
___________  。
。
(2)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:___________ 。( 是弱酸)
是弱酸)
(3)用酸性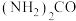 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与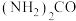 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:___________ 。
(4)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
②将一定比例的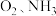 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图): 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在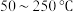 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是___________ 。 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
 接电源的
接电源的___________ (填“正”或“负”)极。
②阳极反应式是___________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下: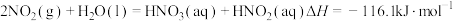
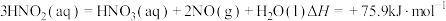
反应
 的
的
 。
。(2)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式: 是弱酸)
是弱酸)(3)用酸性
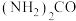 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与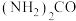 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:(4)在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。②将一定比例的
 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图):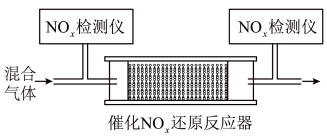
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在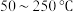 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是
 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
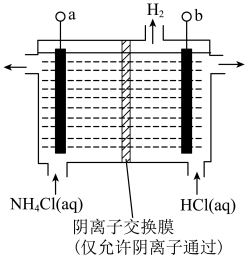
 接电源的
接电源的②阳极反应式是
您最近一年使用:0次
7 . 实验小组制备高铁酸钾 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略) 中反应的化学方程式是
中反应的化学方程式是 ___________ (锰被还原为 )。
)。
②将除杂装置 补充完整并标明所用试剂。
补充完整并标明所用试剂。___________
③ 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有___________ (离子方程式)。
(2)探究 的性质
的性质
①取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案 中溶液变红可知
中溶液变红可知 中含有
中含有___________ 离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由___________ 产生(用离子方程式表示)。
ii.方案 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性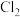
___________ 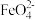 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性
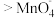 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性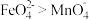 ,请说明理由:
,请说明理由:___________ 。
 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
 中反应的化学方程式是
中反应的化学方程式是  )。
)。②将除杂装置
 补充完整并标明所用试剂。
补充完整并标明所用试剂。③
 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有(2)探究
 的性质
的性质①取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:方案 | 取少量 ,滴加 ,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
方案 | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量 溶出,得到紫色溶液b。取少量 ,滴加盐酸,有 ,滴加盐酸,有 产生。 产生。 |
 中溶液变红可知
中溶液变红可知 中含有
中含有 将
将 氧化,还可能由
氧化,还可能由ii.方案
 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性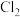
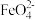 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性

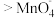 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性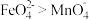 ,请说明理由:
,请说明理由:
您最近一年使用:0次
2024高三·全国·专题练习
8 . 工业上利用黄铁矿(主要成分是FeS2)生产硫酸,同时得到烧渣(主要成分为Fe2O3、少量SiO2和Al2O3),为了“变废为宝”,通过下列生产流程可将烧渣转化为绿矾(FeSO4·7H2O)产品:
(1)滤渣能溶于NaOH,写出该反应的化学方程式:___________ 。
(2)检验“还原”是否完全的实验方法是___________ 。
(3)设计将“还原液”转化为绿矾晶体的实验操作:___________ 得绿矾晶体(在实验过程中须用试剂:FeCO3·H2O、乙醚)。
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:___________ 。
②计算该样品的纯度________ (写出计算过程)。

| 金属离子 | 开始沉淀的pH | 完全沉淀的pH | 沉淀开始溶解的pH | 沉淀完全溶解的pH |
| Fe2+ | 7.6 | 9.6 | / | / |
| Fe3+ | 2.7 | 3.7 | / | / |
| Al3+ | 4.0 | 5.2 | 7.8 | 10.8 |
(2)检验“还原”是否完全的实验方法是
(3)设计将“还原液”转化为绿矾晶体的实验操作:
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:
②计算该样品的纯度
您最近一年使用:0次
名校
解题方法
9 . 室温下,通过下列实验探究某些碳酸盐溶液及碳酸氢盐溶液的性质。
已知: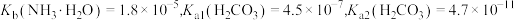 。
。
下列有关说法正确的是
已知:
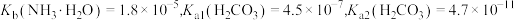 。
。| 实验 | 实验操作和现象 |
| 1 | 测量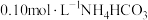 溶液的 溶液的 ,测得 ,测得 为 为 |
| 2 | 测量某浓度的 溶液的 溶液的 ,测得 ,测得 约为9.4 约为9.4 |
| 3 | 将两种浓度均为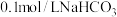 和 和 溶液等体积混合,测量其 溶液等体积混合,测量其 |
A.实验1溶液中: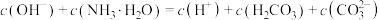 |
B.实验1测得的 值 值 |
C.实验2溶液中: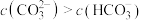 |
D.实验3所得溶液中: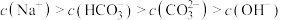 |
您最近一年使用:0次
2024·天津·模拟预测
10 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。___________ 。
②一段时间后,若洗脱液中 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了___________ mol。
(4)常温向 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。___________ 。
A.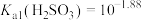
B.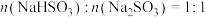 时,溶液显酸性
时,溶液显酸性
C.N点对应的溶液,对水的电离起到抑制作用
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。

②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。

②一段时间后,若洗脱液中
 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了(4)常温向
 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。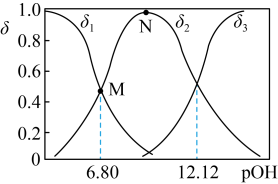
A.
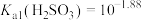
B.
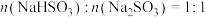 时,溶液显酸性
时,溶液显酸性C.N点对应的溶液,对水的电离起到抑制作用
您最近一年使用:0次



