1 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。请回答下列问题:
(1) 为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备
为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备 的化学方程式为
的化学方程式为_______ 。
(2)工业上一种制取硝酸的流程如图。 转化为
转化为 的化学方程式:
的化学方程式:_______ 。
②生产硝酸的过程中常会产生一些氮的氧化物,用 还原法处理时,能生成两种无污染的产物。写出在催化剂作用下,
还原法处理时,能生成两种无污染的产物。写出在催化剂作用下, 还原法处理含
还原法处理含 的尾气反应的化学方程式:
的尾气反应的化学方程式:_______ 。
③若 最终完全转化为
最终完全转化为 ,计算
,计算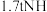 理论上可以得到质量分数为
理论上可以得到质量分数为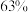 的硝酸溶液
的硝酸溶液_______  。
。
(3) 和
和 (无色)两种气体之间的转化为
(无色)两种气体之间的转化为 。如果
。如果 完全转化成
完全转化成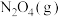 时放出的热量为
时放出的热量为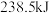 ,请从化学键角度描述能量变化的原因:
,请从化学键角度描述能量变化的原因:_______ 。
(4)向含有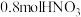 的稀硝酸中慢慢加入
的稀硝酸中慢慢加入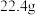 铁粉,反应分为两个阶段,第一阶段为
铁粉,反应分为两个阶段,第一阶段为 (未配平)。在图中画出溶液中
(未配平)。在图中画出溶液中 、
、 的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标表示溶液中离子的物质的量)
的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标表示溶液中离子的物质的量) _______ 。
(1)
 为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备
为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备 的化学方程式为
的化学方程式为(2)工业上一种制取硝酸的流程如图。
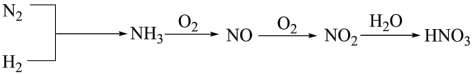
 转化为
转化为 的化学方程式:
的化学方程式:②生产硝酸的过程中常会产生一些氮的氧化物,用
 还原法处理时,能生成两种无污染的产物。写出在催化剂作用下,
还原法处理时,能生成两种无污染的产物。写出在催化剂作用下, 还原法处理含
还原法处理含 的尾气反应的化学方程式:
的尾气反应的化学方程式:③若
 最终完全转化为
最终完全转化为 ,计算
,计算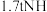 理论上可以得到质量分数为
理论上可以得到质量分数为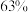 的硝酸溶液
的硝酸溶液 。
。(3)
 和
和 (无色)两种气体之间的转化为
(无色)两种气体之间的转化为 。如果
。如果 完全转化成
完全转化成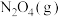 时放出的热量为
时放出的热量为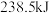 ,请从化学键角度描述能量变化的原因:
,请从化学键角度描述能量变化的原因:(4)向含有
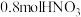 的稀硝酸中慢慢加入
的稀硝酸中慢慢加入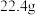 铁粉,反应分为两个阶段,第一阶段为
铁粉,反应分为两个阶段,第一阶段为 (未配平)。在图中画出溶液中
(未配平)。在图中画出溶液中 、
、 的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标表示溶液中离子的物质的量)
的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标表示溶液中离子的物质的量) 
您最近一年使用:0次
解题方法
2 . 某废水处理过程中始终保持 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与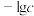 关系如下图所示,c为
关系如下图所示,c为 、
、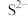 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: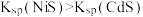 。下列说法正确的是
。下列说法正确的是
 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与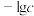 关系如下图所示,c为
关系如下图所示,c为 、
、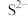 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: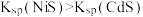 。下列说法正确的是
。下列说法正确的是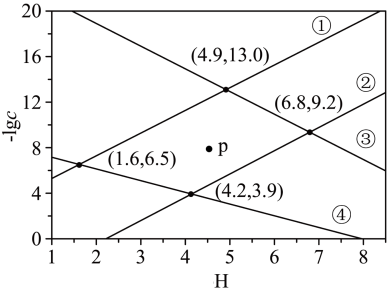
A.④为pH与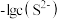 的关系曲线 的关系曲线 |
B.p点生成的沉淀中含有 和 和 |
C. 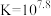 |
D.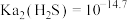 |
您最近一年使用:0次
名校
3 . 电石(CaC2)与水反应生成乙炔,将乙炔通入 溶液中生成Cu2Cl2红棕色沉淀,下列说法正确的是
溶液中生成Cu2Cl2红棕色沉淀,下列说法正确的是
 溶液中生成Cu2Cl2红棕色沉淀,下列说法正确的是
溶液中生成Cu2Cl2红棕色沉淀,下列说法正确的是| A.Cu是第四周期第VIIB族元素 |
B.0.1 mol  中,所含的 中,所含的 键总物质的量为0.2 mol 键总物质的量为0.2 mol |
C.CaC2的电子式可表示为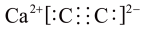 |
D.常温下,将100 mL  的 的 溶液加入足量的NaOH溶液中,可得到448 mL NH3 溶液加入足量的NaOH溶液中,可得到448 mL NH3 |
您最近一年使用:0次
4 . 硼酸溶于水、酒精、甘油、醚类及香精油中,水溶液呈弱酸性。可用作pH值调节剂、消毒剂、抑菌防腐剂等,还可用于电容器制造及电子元件工业。 可以通过电解
可以通过电解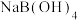 溶液的方法制备,其工作原理如图。下列说法错误的是
溶液的方法制备,其工作原理如图。下列说法错误的是
 可以通过电解
可以通过电解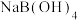 溶液的方法制备,其工作原理如图。下列说法错误的是
溶液的方法制备,其工作原理如图。下列说法错误的是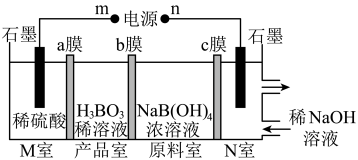
| A.m接外电源的正极 |
B.N室发生的电极反应式为 |
| C.b膜为阳离子交换膜 |
| D.理论上每生成1mol产品,阳极室可生成标准状况下气体的体积是5.6L |
您最近一年使用:0次
名校
5 . 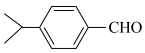 是N的同系物,相对分子质量比N大14,则N的可能结构的种数为
是N的同系物,相对分子质量比N大14,则N的可能结构的种数为
| A.14 | B.15 | C.16 | D.17 |
您最近一年使用:0次
6 . 叠氮化钠( )在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠(
)在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠( )制取叠氮化钠的方程式:
)制取叠氮化钠的方程式: 。实验室用下列装置制取叠氮化钠。
。实验室用下列装置制取叠氮化钠。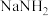 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应。回答下列问题:
有强氧化性,不与酸、碱反应。回答下列问题:
(1)装置A中反应一段时间后再加热装置C的目的是___________ 。
(2)装置A中反应除生成装置C中需要的物质外,还生成 等。其反应的化学方程式为
等。其反应的化学方程式为___________ 。
(3)装置C充分反应后,应先停止加热,再关闭装置A中分液漏斗活塞的原因是___________ 。
(4)①用装置E将尾气 转化为
转化为 ,反应过程中产生的沉淀经过滤、洗涤可获得
,反应过程中产生的沉淀经过滤、洗涤可获得 ,请简述检验沉淀是否洗涤干净的方法:
,请简述检验沉淀是否洗涤干净的方法:___________ 。
②多余的 常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。写出该反应的离子方程式:
常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。写出该反应的离子方程式:___________ 。
(5)用滴定法测定叠氮化钠样品中 的纯度:
的纯度:
a.将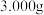 样品配成
样品配成 溶液;
溶液;
b.取 溶液置于锥形瓶中,加入
溶液置于锥形瓶中,加入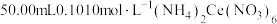 溶液。此过程发生的反应为
溶液。此过程发生的反应为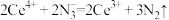 ;
;
c.充分反应后,将溶液稍稀释、酸化、滴入3滴邻菲啰啉指示液,用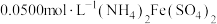 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为
,消耗溶液体积为 。
。
①步骤c中发生反应的离子方程式为___________ 。
②试样中 的纯度为
的纯度为___________ %。
③用精密仪器测定发现,其纯度比上述滴定法测定结果更高,原因可能是___________ (填序号)。
ⅰ. 溶液中
溶液中 被空气中的氧气氧化
被空气中的氧气氧化
ⅱ.滴定前未用标准溶液润洗滴定管
ⅲ.配制 溶液定容时,俯视刻度线
溶液定容时,俯视刻度线
 )在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠(
)在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠( )制取叠氮化钠的方程式:
)制取叠氮化钠的方程式: 。实验室用下列装置制取叠氮化钠。
。实验室用下列装置制取叠氮化钠。
 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应。回答下列问题:
有强氧化性,不与酸、碱反应。回答下列问题:(1)装置A中反应一段时间后再加热装置C的目的是
(2)装置A中反应除生成装置C中需要的物质外,还生成
 等。其反应的化学方程式为
等。其反应的化学方程式为(3)装置C充分反应后,应先停止加热,再关闭装置A中分液漏斗活塞的原因是
(4)①用装置E将尾气
 转化为
转化为 ,反应过程中产生的沉淀经过滤、洗涤可获得
,反应过程中产生的沉淀经过滤、洗涤可获得 ,请简述检验沉淀是否洗涤干净的方法:
,请简述检验沉淀是否洗涤干净的方法:②多余的
 常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。写出该反应的离子方程式:
常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。写出该反应的离子方程式:(5)用滴定法测定叠氮化钠样品中
 的纯度:
的纯度:a.将
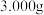 样品配成
样品配成 溶液;
溶液;b.取
 溶液置于锥形瓶中,加入
溶液置于锥形瓶中,加入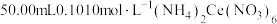 溶液。此过程发生的反应为
溶液。此过程发生的反应为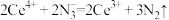 ;
;c.充分反应后,将溶液稍稀释、酸化、滴入3滴邻菲啰啉指示液,用
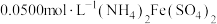 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为
,消耗溶液体积为 。
。①步骤c中发生反应的离子方程式为
②试样中
 的纯度为
的纯度为③用精密仪器测定发现,其纯度比上述滴定法测定结果更高,原因可能是
ⅰ.
 溶液中
溶液中 被空气中的氧气氧化
被空气中的氧气氧化ⅱ.滴定前未用标准溶液润洗滴定管
ⅲ.配制
 溶液定容时,俯视刻度线
溶液定容时,俯视刻度线
您最近一年使用:0次
7 . 在材料科学的广阔领域中,靶材扮演着一个关键角色。镍铂靶主要用于半导体行业中的二极管和超大规模集成电路镀膜。现利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③六水合硫酸镍( )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
④室温: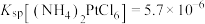 ;
;
(1)铂在王水中生成二元强酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)滤液①中金属阳离子有___________ ,调pH过程中,若 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为___________ 。
(3)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为___________ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(4)沉铂过程中, 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因___________ 。
(5)隔绝空气锻烧 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
___________ L(标准状况)。
(6)通过对滤液控制pH浓缩结晶得到 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是___________ 。
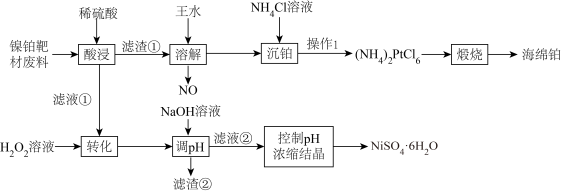
①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(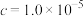 mol/L)的pH mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③六水合硫酸镍(
 )在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。
)在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。④室温:
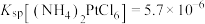 ;
;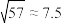
(1)铂在王水中生成二元强酸
 ,该反应的离子方程式为
,该反应的离子方程式为(2)滤液①中金属阳离子有
 为0.01mol/L,则pH的控制范围为
为0.01mol/L,则pH的控制范围为(3)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,恰好使
溶液,恰好使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度为
溶液的浓度为(4)沉铂过程中,
 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(5)隔绝空气锻烧
 时有两种单质生成,分别是Pt和
时有两种单质生成,分别是Pt和 ,当制得金属铂58.5g时,理论上可收集到
,当制得金属铂58.5g时,理论上可收集到
(6)通过对滤液控制pH浓缩结晶得到
 晶体,而不是蒸发结晶的原因是
晶体,而不是蒸发结晶的原因是
您最近一年使用:0次
名校
解题方法
8 . 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则

___________  。
。
(2)①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
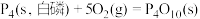
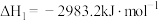
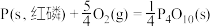
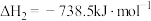
则该温度下白磷转化为红磷的热化学方程式为___________ 。相同状况下,能量较低的是___________ (填“红磷”或“白磷”),白磷的稳定性比红___________ (填“高”或“低”)。
(3)已知:①

②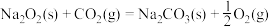
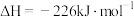
则 与
与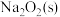 反应放出509kJ热量时,电子转移数目为
反应放出509kJ热量时,电子转移数目为___________ 。
(4)已知
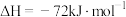 ,蒸发1mol
,蒸发1mol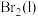 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:
则表中
___________ 。
(5)在容积为2L的恒温密闭容器中,充入1mol 和3mol
和3mol 一定条件下发生反应:
一定条件下发生反应: 能说明上述反应达到平衡状态的是___________(填字母)
能说明上述反应达到平衡状态的是___________(填字母)
(6)将燃煤产生的二氧化碳回收利用,可做到低碳排放。如图是通过人工光合作用以 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为
的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为___________ 。
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则


 。
。(2)①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
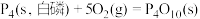
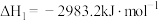
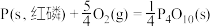
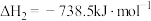
则该温度下白磷转化为红磷的热化学方程式为
(3)已知:①


②
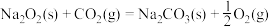
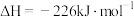
则
 与
与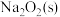 反应放出509kJ热量时,电子转移数目为
反应放出509kJ热量时,电子转移数目为(4)已知

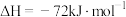 ,蒸发1mol
,蒸发1mol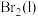 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:| 物质 |  | 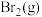 | 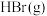 |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |

(5)在容积为2L的恒温密闭容器中,充入1mol
 和3mol
和3mol 一定条件下发生反应:
一定条件下发生反应: 能说明上述反应达到平衡状态的是___________(填字母)
能说明上述反应达到平衡状态的是___________(填字母)A.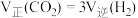 |
| B.混合气体的密度不随时间的变化而变化 |
C.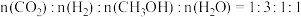 |
| D.混合气体的平均摩尔质量不随时间的变化而变化 |
(6)将燃煤产生的二氧化碳回收利用,可做到低碳排放。如图是通过人工光合作用以
 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为
的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为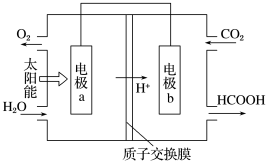
您最近一年使用:0次
名校
解题方法
9 . 邻苯二甲酸二乙酯(F)在医药、香料、塑料、橡胶以及涂料等领域应用广泛,其合成路线如图所示,D是最简单的烯烃,请回答下列问题:___________ ,B的结构简式为___________ 。
(2)C+E→F的化学方程式为___________ ,D→E的反应类型为___________ 。
(3)1 mol A与足量Na反应生成 的体积(标准状况下)为
的体积(标准状况下)为___________ L。
(4)D能发生聚合反应生成高分子X,X的链节为___________ 。
(5)与E具有相同官能团的H比E多一个O,下列物质(不考虑稳定性)中,与H互为同分异构体的是___________ (填标号,下同),互为同系物的是___________ 。
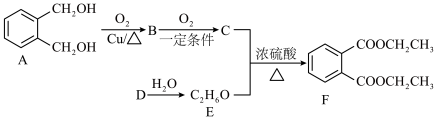
(2)C+E→F的化学方程式为
(3)1 mol A与足量Na反应生成
 的体积(标准状况下)为
的体积(标准状况下)为(4)D能发生聚合反应生成高分子X,X的链节为
(5)与E具有相同官能团的H比E多一个O,下列物质(不考虑稳定性)中,与H互为同分异构体的是
① ②
②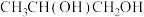 ③
③ ④
④ ⑤
⑤
您最近一年使用:0次
名校
10 . 请回答下列问题:
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是___________ 。(填字母)
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有___________ 。(填字母)
a. b.盐酸和镁条
b.盐酸和镁条
c.盐酸和碳酸氢钠 d. 和氯化铵
和氯化铵
e. 分解
分解
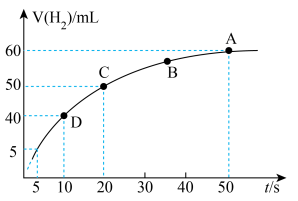
③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为___________ ;在20s内用H+浓度表示的平均反应速率
___________ (20s时溶液体积为50mL,气体摩尔体积为25L/mol)。 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。
t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:
①4-6min内 的平均反应速率
的平均反应速率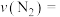
___________ 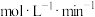
②下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.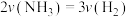 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化
C. 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变
③如表列出了在不同温度和压强下,反应达到平衡时 的百分含量
的百分含量 。
。
从表中数据得出,合成氨最优的条件是___________ 。
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。
①制作冷敷袋常利用吸热的化学变化来实现,以下组合最能满足的是
A.冰 B.硝酸铵+水 C.硝酸铵+水合碳酸钠
②下列过程中的热量变化与冰袋一致的有
a.
 b.盐酸和镁条
b.盐酸和镁条c.盐酸和碳酸氢钠 d.
 和氯化铵
和氯化铵e.
 分解
分解③某课外实验小组利用压强传感器、温度传感器、数据采集器和计算机等数字化实验设备,探究镁与一定量盐酸的反应速率,测得产生
 的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
的体积与反应时间的关系曲线如图所示,结合所学知识分析速率变化的原因为
 ,是一个常见的放热反应。回答下列问题。
,是一个常见的放热反应。回答下列问题。t℃时,向填充有催化剂、体积为2L的刚性容器中充入一定量的
 和
和 合成氨,实验中测得
合成氨,实验中测得 随时间的变化如表所示:
随时间的变化如表所示:①4-6min内
 的平均反应速率
的平均反应速率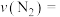
| 时间/min | 2 | 4 | 6 | 8 | 10 | 12 |
 / / | 0.04 | 0.10 | 0.14 | 0.16 | 0.16 | 0.16 |
A.
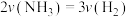 B.混合气体的平均相对分子质量不再变化
B.混合气体的平均相对分子质量不再变化C.
 体积分数不再变化 D.混合气体的密度保持不变
体积分数不再变化 D.混合气体的密度保持不变③如表列出了在不同温度和压强下,反应达到平衡时
 的百分含量
的百分含量 。
。压强/MPa % %温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
您最近一年使用:0次



