名校
1 . 一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
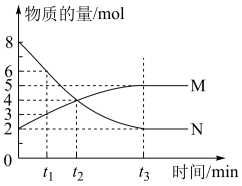
(1)该反应的化学反应方程式是___________ ;
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:___________ ;
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=___________ L;
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是___________ (填序号)
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
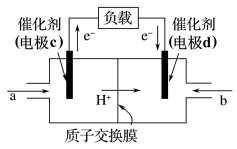
①则电极d是___________  填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为___________ ;
②若线路中转移2mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。

(1)该反应的化学反应方程式是
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
①则电极d是
 填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为②若线路中转移2mol电子,则该燃料电池理论上消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021-07-09更新
|
840次组卷
|
4卷引用:广东省东莞市东华中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
2 . 将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___ 。
(2)反应前A的物质的量浓度是___ 。
(3)10s末,生成物D的浓度为___ 。
(4)A与B的平衡转化率之比为___ 。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度___ ;增大A的浓度___ ;恒容下充入氖气___ 。
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。(1)用C表示10s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10s末,生成物D的浓度为
(4)A与B的平衡转化率之比为
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):降低温度
您最近一年使用:0次
2021-06-30更新
|
553次组卷
|
2卷引用:广东省东莞市东华中学2021-2022学年高一下学期期中考试化学试题
3 . 依据化学能与热能的相关知识回答下列问题:
I.已知化学反应N2+3H2 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题:
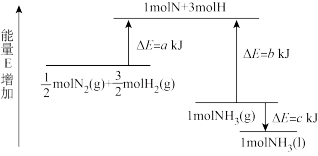
(1)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程___ (填“吸收”或“放出”)____ kJ能量(用a、b、c字母表示,下同),NH3(g)到NH3(l)过程能量变化为____ kJ。
II.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(2)则发生P4(白磷)+3O2(g)=P4O6(s)的反应是________ (填“吸热”或“放热”)反应;其中,生成1 mol P4O6需要_____ (“吸收或放出”)能量为_____ kJ
I.已知化学反应N2+3H2
 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题: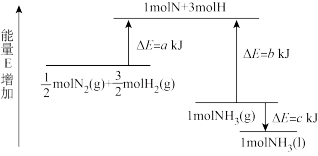
(1)0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程
II.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(2)则发生P4(白磷)+3O2(g)=P4O6(s)的反应是
您最近一年使用:0次
名校
解题方法
4 . 某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:

(1)由图中所给数据进行分析,该反应的化学方程式为_______ 。
(2)下列措施能加快反应速率的是_______ (填序号,下同)。
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(3)能说明该反应已达到平衡状态的是_______ (填字母)。
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应从开始至2 min,用X的浓度变化表示的平均反应速率v(X)=_______ 。
(5)将5 mol X与3 mol Y的混合气体通入2 L的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体X的转化率=_______ 。

(1)由图中所给数据进行分析,该反应的化学方程式为
(2)下列措施能加快反应速率的是
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(3)能说明该反应已达到平衡状态的是
A.v(X)=v(Y) B.2v正(Y)=v逆(Z) C.容器内压强保持不变
D.容器内混合气体的密度保持不变 E.X、Y、Z的浓度相等
(4)反应从开始至2 min,用X的浓度变化表示的平均反应速率v(X)=
(5)将5 mol X与3 mol Y的混合气体通入2 L的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体X的转化率=
您最近一年使用:0次
2021-06-19更新
|
1061次组卷
|
6卷引用:广东省汕头市潮阳林百欣中学2021-2022学年高一下学期 期中考试化学试题
解题方法
5 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
名校
解题方法
6 . 有氯化钠,碳酸钠,碳酸氢钠固体混合物共4克,加热到质量不再减少为止,此时剩余固体质量为3.38克,在残留的固体中加入足量盐酸,将产生的气体通过干燥管后,通入澄清石灰水中,生成2g固体。
(1)原混合物中碳酸氢钠的质量是多少?___
(2)标准状况下,加热时生成的气体的体积是多少?___
(3)原混合物中碳酸钠的质量是多少?___
(1)原混合物中碳酸氢钠的质量是多少?
(2)标准状况下,加热时生成的气体的体积是多少?
(3)原混合物中碳酸钠的质量是多少?
您最近一年使用:0次
7 . 请完成下列填空:
(1)3.01×1023个氯气分子的物质的量是___ 。
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为___ ,各自所含有的原子数之比为____ 。
(3)3.1gNa2X含有Na+0.1mol,则Na2X的摩尔质量为___ 。
(4)23gNa与足量H2O反应,产生的气体在标准状况下的体积为___ 。
(1)3.01×1023个氯气分子的物质的量是
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为
(3)3.1gNa2X含有Na+0.1mol,则Na2X的摩尔质量为
(4)23gNa与足量H2O反应,产生的气体在标准状况下的体积为
您最近一年使用:0次
名校
8 . 物质的量是高中化学中广泛应用的物理量,依据相关公式计算下列数值。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是__ mol,质量是__ g。
(2)标准状况下11.2LCO2所含氧原子的数目是__ NA,与_ gH2O具有的氧原子数目相同。
(3)将5.4gAl放入氢氧化钠溶液中完全反应,生成气体体积__ L。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是
(2)标准状况下11.2LCO2所含氧原子的数目是
(3)将5.4gAl放入氢氧化钠溶液中完全反应,生成气体体积
您最近一年使用:0次
9 . 实验室常用KMnO4与浓盐酸反应来制备氯气:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,在此反应中:
(1)氧化剂是______ ,氧化产物是______ 。(填化学式)
(2)氧化剂与还原剂的物质的量之比为______ 。
(3)若生成71 g Cl2,则消耗的HCl是______ mol,被氧化的HCl是______ mol,转移的电子的物质的量是______ mol。
(4)将此反应改写成离子方程式______ 。
(1)氧化剂是
(2)氧化剂与还原剂的物质的量之比为
(3)若生成71 g Cl2,则消耗的HCl是
(4)将此反应改写成离子方程式
您最近一年使用:0次
2021-03-02更新
|
387次组卷
|
2卷引用:广东省汕尾市2020-2021学年高一上学期期末学业质量监测化学试题
名校
解题方法
10 . 现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的 ;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程:______ 。
(2)写出基态F原子的核外电子排布式:______ 。
(3)A2D的电子式为______ ,其分子中______ (填“含”或“不含”,下同) 键,
键,______ π键。
(4)A、B、C共同形成的化合物中化学键的类型有______ 。
 ;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题:
(1)用电子式表示C和E形成化合物的过程:
(2)写出基态F原子的核外电子排布式:
(3)A2D的电子式为
 键,
键,(4)A、B、C共同形成的化合物中化学键的类型有
您最近一年使用:0次
2021-02-16更新
|
2266次组卷
|
5卷引用:广东省佛山市顺德市李兆基中学2022-2023学年高二下学期3月月考化学试题
广东省佛山市顺德市李兆基中学2022-2023学年高二下学期3月月考化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键(已下线)2.1 共价键(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)甘肃省武威市凉州区2022-2023学年高二下学期期中考试化学试题



