解题方法
1 . 完成下列问题。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g) 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol
2NO (g)+O2(g) 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol
则反应NO2(g)+ SO2 (g) NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = _______ 
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是_______ (填字母)。
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成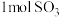 消耗
消耗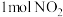
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
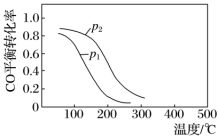
①ΔH_______ (填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______ 。
③下列说法正确的是_______ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=_______ 。
⑤ 200 ℃时,该反应的平衡常数K=_______ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则此时该反应的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g)
 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol2NO (g)+O2(g)
 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol则反应NO2(g)+ SO2 (g)
 NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = 
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成
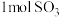 消耗
消耗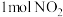
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤ 200 ℃时,该反应的平衡常数K=
您最近一年使用:0次
名校
解题方法
2 . “碳中和”是指企业、团体或个人测算在一定时间内,直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。简单地说,也就是让二氧化碳排放量“收支相抵”。利用CO2合成二甲醚在近年来深受人们的关注,可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为_______ 。
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是_______ ;
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是_______ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因_______ 。
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
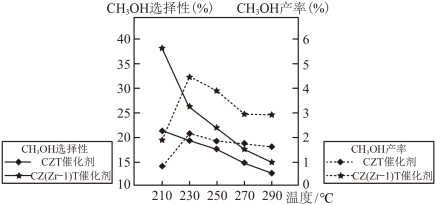
其中:CH3OH的选择性=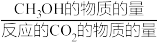 ×100%
×100%
在上述条件下合成甲醇的工业条件是_______。
(5)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应I和反应II,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则达到平衡时H2的转化率为_______ ,反应II的平衡常数K=_______ (保留两位有效数字)。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=
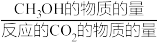 ×100%
×100%在上述条件下合成甲醇的工业条件是_______。
| A.210℃ | B.230℃ | C.催化CZT | D.催化剂CZ(Zr-1)T |
您最近一年使用:0次
2022-11-05更新
|
410次组卷
|
3卷引用:湖北省荆州市沙市中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
3 . 我国的能源以煤炭为主,燃煤烟气中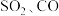 等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。
等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。
(1)已知常温常压下,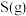 的燃烧热为
的燃烧热为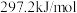 ,CO(g)的燃烧热为
,CO(g)的燃烧热为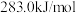 ,则CO还原脱除
,则CO还原脱除 :
: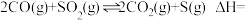
_______ 。
(2)在某温度时,进行CO还原脱除 :
: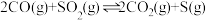 。
。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是_______ 。
A. B.CO与SO2的浓度之比不再改变
B.CO与SO2的浓度之比不再改变
C.容器内的压强不再改变 D.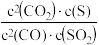 的值不再改变
的值不再改变
②若控制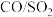 进料比(物质的量)为4∶1,反应达平衡时,混合气体中
进料比(物质的量)为4∶1,反应达平衡时,混合气体中 的体积分数为5%,则该反应在此温度下的平衡常数为
的体积分数为5%,则该反应在此温度下的平衡常数为_______ 。
(3)在600℃时,发生如下系列反应,测得不同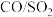 进料比(物质的量)下平衡体系各物质分布如图所示(图中
进料比(物质的量)下平衡体系各物质分布如图所示(图中 起始投料固定为
起始投料固定为 )。
)。

反应I: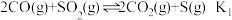
反应II:
反应III:
①该条件下,为减少有毒物质COS的产生,同时脱除 ,实际生产中应控制
,实际生产中应控制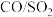 进料比为
进料比为_______ ,在进料比大于2.5之后,COS的含量会明显增大,试分析原因_______ 。
②根据图中曲线,可判断
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如图。若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为_______ 。

 等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。
等有害气体的排放会污染环境,用CO还原脱除SO2将其转化为单质硫,对工业生产具有重要的意义。(1)已知常温常压下,
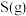 的燃烧热为
的燃烧热为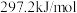 ,CO(g)的燃烧热为
,CO(g)的燃烧热为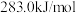 ,则CO还原脱除
,则CO还原脱除 :
: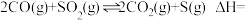
(2)在某温度时,进行CO还原脱除
 :
: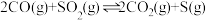 。
。①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是
A.
 B.CO与SO2的浓度之比不再改变
B.CO与SO2的浓度之比不再改变C.容器内的压强不再改变 D.
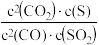 的值不再改变
的值不再改变②若控制
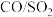 进料比(物质的量)为4∶1,反应达平衡时,混合气体中
进料比(物质的量)为4∶1,反应达平衡时,混合气体中 的体积分数为5%,则该反应在此温度下的平衡常数为
的体积分数为5%,则该反应在此温度下的平衡常数为(3)在600℃时,发生如下系列反应,测得不同
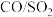 进料比(物质的量)下平衡体系各物质分布如图所示(图中
进料比(物质的量)下平衡体系各物质分布如图所示(图中 起始投料固定为
起始投料固定为 )。
)。
反应I:
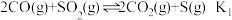
反应II:

反应III:

①该条件下,为减少有毒物质COS的产生,同时脱除
 ,实际生产中应控制
,实际生产中应控制 进料比为
进料比为②根据图中曲线,可判断

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如图。若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为

您最近一年使用:0次
2022-11-05更新
|
884次组卷
|
6卷引用:湖北省武汉市洪山区武汉西藏中学2023-2024学年高三上学期1月期末理综试题-高中化学
解题方法
4 . 乙醇是一种重要的工业原料,广泛应用于能源、化工、食品等领域。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:
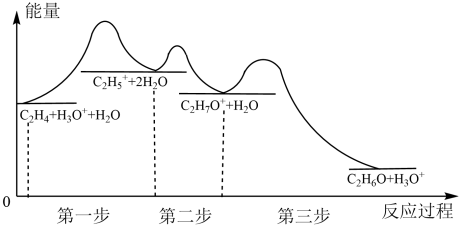
(1)图中所示活化能最大的步骤是第_______ 步。
(2)写出该反应过程中速率最快的基元反应:_______ 。
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①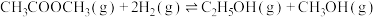
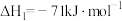
②

(3)已知反应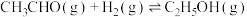 的
的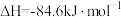 ,则
,则
_______ 。
(4)在体积密闭容器中进行上述反应时发现, 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是_______ 。
Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
(5)实际生产中,一般控制乙酸过量。若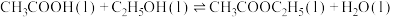
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有_______ 。
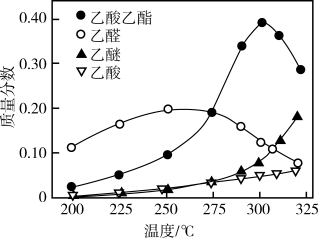
(6)一种新的乙醇催化合成乙酸乙酯的方法如下: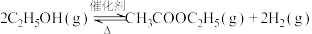 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:

(1)图中所示活化能最大的步骤是第
(2)写出该反应过程中速率最快的基元反应:
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①
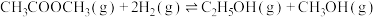
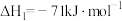
②


(3)已知反应
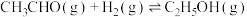 的
的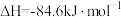 ,则
,则
(4)在体积密闭容器中进行上述反应时发现,
 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
| 纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
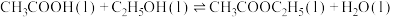
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有(6)一种新的乙醇催化合成乙酸乙酯的方法如下:
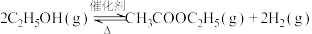 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
| A.该反应的最宜温度应为325℃ |
| B.适当减小体系压强,有利于提高乙醇平衡转化率 |
| C.在催化剂作用下,乙醚是反应历程中的中间产物 |
| D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键 |
您最近一年使用:0次
2022-11-03更新
|
171次组卷
|
2卷引用:湖北省鄂东南联盟2022-2023学年高三上学期期中联考化学试题
名校
5 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ. CO2(g)+H2(g) CO(g)+H2O(g) ΔH=-c kJ/mol。
CO(g)+H2O(g) ΔH=-c kJ/mol。
回答下列问题:
(1)a=_______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b_______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。
①下列叙述能表示该反应达到平衡状态的是_______ (填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
②该反应达到平衡时,其他条件不变,通入CO2时,则v(正)_______ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
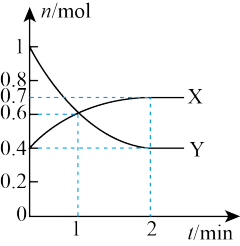
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
①Y为_______ (填化学式)。
②0~1min时v(CO)为_______ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=_______ 。
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ. CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=-c kJ/mol。
CO(g)+H2O(g) ΔH=-c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。
①下列叙述能表示该反应达到平衡状态的是
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
②该反应达到平衡时,其他条件不变,通入CO2时,则v(正)

(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
您最近一年使用:0次
2022-11-03更新
|
123次组卷
|
2卷引用:湖北省宜昌市协作体2022-2023学年高二上学期期中考试化学试题
名校
6 .
(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
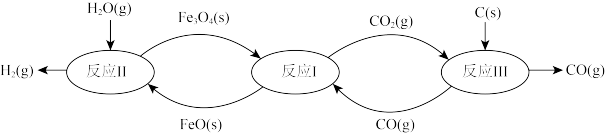
已知:i. Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
ii. 3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
iii. C(s)+CO2(g) 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是_______________ 。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s) 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
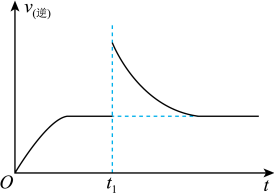
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示:
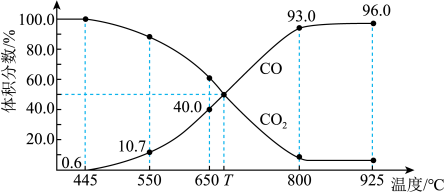
①650℃时,该反应达平衡后吸收的热量是___________________________________________ 。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡________________ (填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为________________ 。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、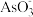 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为______________________ 。

(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。 
已知:i. Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1ii. 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1iii. C(s)+CO2(g)
 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s)
 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
| A.保持温度不变,压缩容器 | B.保持体积不变,升高温度 |
| C.保持体积不变,加少量碳粉 | D.保持体积不变,增大CO浓度 |

①650℃时,该反应达平衡后吸收的热量是
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为
(4)用原电池原理可以除去酸性废水中的三氯乙烯、
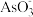 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
您最近一年使用:0次
7 . 甲醇制烯烃是一项非石油路线烯烃生产技术,可以减少我国对石油进口的依赖度。回答下列问题:
(1)甲醇制烯烃的反应是不可逆反应,烯烃产物之间存在如下转化关系:
反应Ⅰ: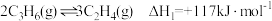
反应Ⅱ: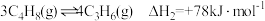
反应Ⅲ: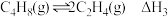
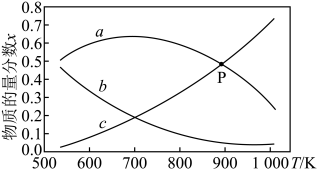
反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。
①反应Ⅲ的△H3=_______ kJ∙mol-1。
②图1中曲线c代表的组分是_______ (填化学式)。700K后,曲线a下降的原因是_______ 。
③向恒温恒容密闭容器中充入一定量C4H8,控制条件只发生反应Ⅲ,下列能表明反应Ⅲ已达到平衡状态的是_______ 。
A.v正(C4H8)=2v逆(C2H4) B.混合气体的密度不再变化
C.容器中气体的压强不再变化 D.混合气体的平均相对分子质量不再变化
④上图中P点坐标为(900,0.48),900K时,反应Ⅲ的物质的量分数平衡常数Kx=_______ 。(以物质的量分数代替浓度计算)。
(2)甲醇催化制取丙烯的反应为: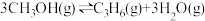 ,反应的Arrhenius经验公式的实验数据如图所示。
,反应的Arrhenius经验公式的实验数据如图所示。
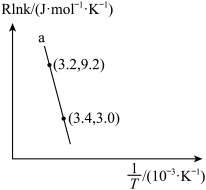
已知Arrhenius经验公式为: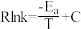 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=_______ kJ∙mol-1
②下列措施能使速率常数k增大的是_______ 。
A.增大压强 B.升高温度 C.增大c(CH3OH) D.更换适宜催化剂
(1)甲醇制烯烃的反应是不可逆反应,烯烃产物之间存在如下转化关系:
反应Ⅰ:
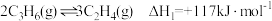
反应Ⅱ:
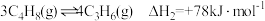
反应Ⅲ:
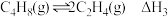
反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。

①反应Ⅲ的△H3=
②图1中曲线c代表的组分是
③向恒温恒容密闭容器中充入一定量C4H8,控制条件只发生反应Ⅲ,下列能表明反应Ⅲ已达到平衡状态的是
A.v正(C4H8)=2v逆(C2H4) B.混合气体的密度不再变化
C.容器中气体的压强不再变化 D.混合气体的平均相对分子质量不再变化
④上图中P点坐标为(900,0.48),900K时,反应Ⅲ的物质的量分数平衡常数Kx=
(2)甲醇催化制取丙烯的反应为:
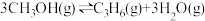 ,反应的Arrhenius经验公式的实验数据如图所示。
,反应的Arrhenius经验公式的实验数据如图所示。
已知Arrhenius经验公式为:
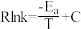 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。①该反应的活化能Ea=
②下列措施能使速率常数k增大的是
A.增大压强 B.升高温度 C.增大c(CH3OH) D.更换适宜催化剂
您最近一年使用:0次
8 . 天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
①ΔH1=_______ kJ·mol-1。
②提高该反应平衡转化率的方法有_______ 、_______ 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为v=k×c(CH4),其中k为反应速率常数。
C2H6+H2。反应在初期阶段的速率方程为v=k×c(CH4),其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_______ r1。
②对于处于初期阶段的该反应,下列说法正确的是_______ 。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)甲烷-空气燃料电池是一种高效能、低污染电池,利用此电池可作电源,则在酸性介质中此电池负极的电极反应式为_______ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH(kJ·mol-1) | -1560 | -1411 | -286 |
②提高该反应平衡转化率的方法有
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2。反应在初期阶段的速率方程为v=k×c(CH4),其中k为反应速率常数。
C2H6+H2。反应在初期阶段的速率方程为v=k×c(CH4),其中k为反应速率常数。①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)甲烷-空气燃料电池是一种高效能、低污染电池,利用此电池可作电源,则在酸性介质中此电池负极的电极反应式为
您最近一年使用:0次
9 . 乙烯是一种重要的有机化工原料,广泛用于生产聚乙烯和氯乙烯。工业上利用乙烷为原料,通过如下反应Ⅰ或反应Ⅱ制得乙烯。回答下列问题:
反应Ⅰ:乙烷直接脱氢的原理:C2H6(g) C2H4(g)+H2(g) △H1
C2H4(g)+H2(g) △H1
(1)已知C2H6、C2H4、H2的燃烧热△H分别为-1560 kJ/mol、-1411 kJ/mol和-286 kJ/mol,则乙烯脱氢的反应△H1为_______ kJ/mol。
(2)科技工作者结合实验与计算机模拟结果,研究了乙烷在催化剂表面脱氢制乙烯的反应,其部分历程如下图1所示(吸附在催化剂表面的物种用*标注,TS表示过渡态):
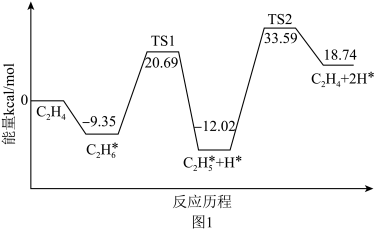
此部分历程中最大的活化能Ea=_______ kJ/mol,该步骤的反应方程式为_______ 。
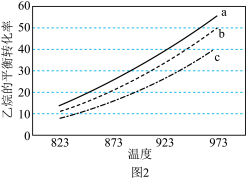
(3)在压强恒为p的条件下,n(N2):n(C2H6)分别为a、b、c时,乙烷的平衡转化率与温度变化的关系如图2所示,则a、b、c的大小关系为_______ ;当n(N2):n(C2H6)=1,温度为973 K时,乙烷的转化率为50%,则反应的Kp=_______ 。
反应Ⅱ:CO2氧化乙烷制脱氢的原理C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g)
C2H4(g)+CO(g)+H2O(g)
(4)有研究表明CrO3催化CO2氧化乙烷制乙烯的机理可分为两步,其中第一步反应为3C2H6+2CrO3 3C2H4+Cr2O3+3H2O,则第二步反应为
3C2H4+Cr2O3+3H2O,则第二步反应为_______ 。
(5)已知CO2氧化乙烷脱氢容易发生副反应:C2H6(g)+2CO2(g) 4CO(g)+3H2O(g),当n(CO2):n(C2H6)=1:1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
4CO(g)+3H2O(g),当n(CO2):n(C2H6)=1:1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是_______ 。若想提高C2H4的产率,应当_______ 。
反应Ⅰ:乙烷直接脱氢的原理:C2H6(g)
 C2H4(g)+H2(g) △H1
C2H4(g)+H2(g) △H1(1)已知C2H6、C2H4、H2的燃烧热△H分别为-1560 kJ/mol、-1411 kJ/mol和-286 kJ/mol,则乙烯脱氢的反应△H1为
(2)科技工作者结合实验与计算机模拟结果,研究了乙烷在催化剂表面脱氢制乙烯的反应,其部分历程如下图1所示(吸附在催化剂表面的物种用*标注,TS表示过渡态):

此部分历程中最大的活化能Ea=
(3)在压强恒为p的条件下,n(N2):n(C2H6)分别为a、b、c时,乙烷的平衡转化率与温度变化的关系如图2所示,则a、b、c的大小关系为

反应Ⅱ:CO2氧化乙烷制脱氢的原理C2H6(g)+CO2(g)
 C2H4(g)+CO(g)+H2O(g)
C2H4(g)+CO(g)+H2O(g)(4)有研究表明CrO3催化CO2氧化乙烷制乙烯的机理可分为两步,其中第一步反应为3C2H6+2CrO3
 3C2H4+Cr2O3+3H2O,则第二步反应为
3C2H4+Cr2O3+3H2O,则第二步反应为(5)已知CO2氧化乙烷脱氢容易发生副反应:C2H6(g)+2CO2(g)
 4CO(g)+3H2O(g),当n(CO2):n(C2H6)=1:1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
4CO(g)+3H2O(g),当n(CO2):n(C2H6)=1:1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:| 催化剂 | C2H6的转化率 | CO2的转化率 | C2H4的转化率 |
| X | 19.0% | 37.6% | 3.3% |
您最近一年使用:0次
2022-10-20更新
|
248次组卷
|
2卷引用:湖北省腾云联盟2022-2023学年高三上学期10月联考化学试题
解题方法
10 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I. 脱硝: 已知:H2的燃烧热为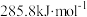 ;
;
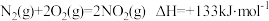 ;
; 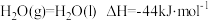
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_______ 。
II.脱碳:
(2)向2L密闭容器中加入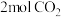 和
和 ,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 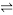 CH3OH(1)+H2O(l) △H<0
CH3OH(1)+H2O(l) △H<0
①该反应自发进行的条件是_______ (填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是_______ (填字母)。
a.混合气体的平均相对分子质量保持不变 b. 和H2的体积分数保持不变
和H2的体积分数保持不变
c. 和H2的转化率相等 d.混合气体的密度保持不变
和H2的转化率相等 d.混合气体的密度保持不变
e.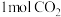 生成的同时有
生成的同时有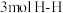 键断裂
键断裂
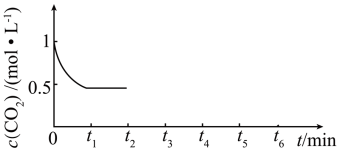
③ 的浓度随时间(
的浓度随时间( )变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出
)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出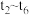 时间段
时间段 浓度随时间的变化。
浓度随时间的变化。_______
(3)改变温度,使反应CO2(g)+3H2(g)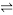 CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应I、II对比:平衡常数K(I)_______ K(II)(填“>”“<”或“=”,下同);平衡时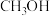 的浓度c(I)
的浓度c(I)_______ c(II)。
②对反应I,前10min内的平均反应速率 =
=_______ ;在其他条件不变的情况下,若30min时只向容器中再充入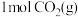 和
和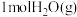 ,则平衡
,则平衡__ (填“正向”“逆向”或“不”)移动。
I. 脱硝: 已知:H2的燃烧热为
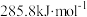 ;
;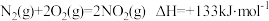 ;
; 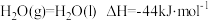
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
II.脱碳:
(2)向2L密闭容器中加入
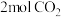 和
和 ,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 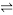 CH3OH(1)+H2O(l) △H<0
CH3OH(1)+H2O(l) △H<0①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变 b.
 和H2的体积分数保持不变
和H2的体积分数保持不变c.
 和H2的转化率相等 d.混合气体的密度保持不变
和H2的转化率相等 d.混合气体的密度保持不变e.
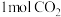 生成的同时有
生成的同时有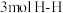 键断裂
键断裂③
 的浓度随时间(
的浓度随时间(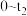 )变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出
)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出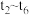 时间段
时间段 浓度随时间的变化。
浓度随时间的变化。
(3)改变温度,使反应CO2(g)+3H2(g)
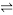 CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:| 反应时间(min) |  (mol) (mol) |  (mol) (mol) | 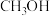 (mol) (mol) |  (mol) (mol) | |
| 反应I:恒温恒容 | 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | ||||
| 20 | 1 | ||||
| 30 | 1 | ||||
| 反应II:绝热恒容 | 0 | 0 | 0 | 2 | 2 |
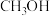 的浓度c(I)
的浓度c(I)②对反应I,前10min内的平均反应速率
 =
=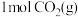 和
和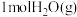 ,则平衡
,则平衡
您最近一年使用:0次



