解题方法
1 . 自发进行的化学反应大多数是_____ 反应,也有些是_____ 反应。(填“吸热”或“放热”)
您最近一年使用:0次
名校
2 . 利用二氧化碳和氢气合成甲醇可以有效降低二氧化碳的排放量。
已知:①
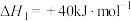

②


回答下面问题:
(1)利用二氧化碳和氢气合成甲醇的反应为:
 。已知该反应能够自发进行,则
。已知该反应能够自发进行,则
_______ (填“<”“>”或“=”)0,
_______ 0。该反应的平衡常数
_______ (用 和
和 表示),随着温度逐渐升高,
表示),随着温度逐渐升高, 将
将_______ (填“增大”或“减小”)。
(2)在某密闭容器中只发生反应②

①下面措施一定能提高CO的平衡转化率的是_______ 。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
②该反应的正活化能 (正)
(正)_______ (填“<”“>”或“=”)逆活化能 (逆)。
(逆)。
(3)在某密闭容器中通入 和
和 ,只发生反应②
,只发生反应②
 ,反应中CO的平衡转化率随温度和压强的变化如下:
,反应中CO的平衡转化率随温度和压强的变化如下:
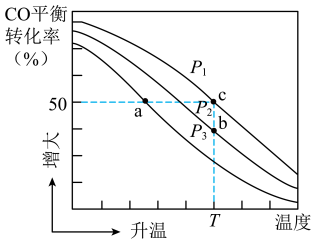
①随温度逐渐升高CO平衡转化率降低的原因是_______ 。
②压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
③a、b、c三点对应的压强平衡常数分别为 、
、 、
、 ,由大到小的顺序是
,由大到小的顺序是_______ 。
④写出c点的压强平衡常数
_______ 。
已知:①

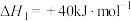

②



回答下面问题:
(1)利用二氧化碳和氢气合成甲醇的反应为:

 。已知该反应能够自发进行,则
。已知该反应能够自发进行,则


 和
和 表示),随着温度逐渐升高,
表示),随着温度逐渐升高, 将
将(2)在某密闭容器中只发生反应②


①下面措施一定能提高CO的平衡转化率的是
A.高温高压 B.高温低压 C.低温高压 D.低温低压
②该反应的正活化能
 (正)
(正) (逆)。
(逆)。(3)在某密闭容器中通入
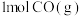 和
和 ,只发生反应②
,只发生反应②
 ,反应中CO的平衡转化率随温度和压强的变化如下:
,反应中CO的平衡转化率随温度和压强的变化如下:
①随温度逐渐升高CO平衡转化率降低的原因是
②压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是③a、b、c三点对应的压强平衡常数分别为
 、
、 、
、 ,由大到小的顺序是
,由大到小的顺序是④写出c点的压强平衡常数

您最近一年使用:0次
3 . 为了实现“碳中和”,研发 的利用技术成为热点。
的利用技术成为热点。
反应I:
反应Ⅱ:
请回答:
(1)反应I能够自发进行的条件是__________ 。
(2)向 的恒容密闭容器中充入
的恒容密闭容器中充入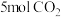 和
和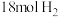 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量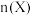 与温度
与温度 的关系如下图所示。
的关系如下图所示。
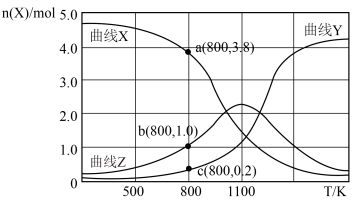
①写出曲线Y表示的含碳元素物质的化学式__________ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
__________ [对于气相反应,用某组分 的平衡压强
的平衡压强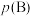 代替物质的量浓度
代替物质的量浓度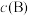 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如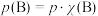 ,
, 为平衡总压强,
为平衡总压强,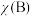 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(3)可用 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: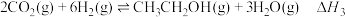 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、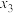 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示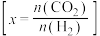 :
:

①上述反应的活化能 (正)
(正)__________  (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
② 、
、 、
、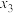 由大到小的顺序是
由大到小的顺序是__________ 。
③从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因__________ 。
(4)科学家提出由 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中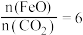 ,则
,则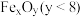 的化学式为
的化学式为__________ 。

(5)水系可逆 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:

①放电时复合膜中向 极移动的离子是
极移动的离子是__________ 。
②充电时多孔 纳米片电极的电极反应式为
纳米片电极的电极反应式为__________ 。
 的利用技术成为热点。
的利用技术成为热点。反应I:

反应Ⅱ:

请回答:
(1)反应I能够自发进行的条件是
(2)向
 的恒容密闭容器中充入
的恒容密闭容器中充入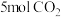 和
和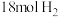 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量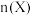 与温度
与温度 的关系如下图所示。
的关系如下图所示。
①写出曲线Y表示的含碳元素物质的化学式
②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
 的平衡压强
的平衡压强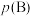 代替物质的量浓度
代替物质的量浓度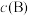 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如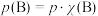 ,
, 为平衡总压强,
为平衡总压强,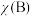 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(3)可用
 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: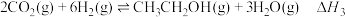 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、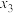 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示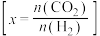 :
:
①上述反应的活化能
 (正)
(正) (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②
 、
、 、
、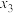 由大到小的顺序是
由大到小的顺序是③从平衡角度分析,随温度升高,不同投料比时
 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因(4)科学家提出由
 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中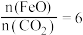 ,则
,则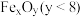 的化学式为
的化学式为
(5)水系可逆
 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:
①放电时复合膜中向
 极移动的离子是
极移动的离子是②充电时多孔
 纳米片电极的电极反应式为
纳米片电极的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 下列基于事实做出的分析不正确 的是
A. 与Al发生铝热反应的条件为高温,说明该反应需吸收能量 与Al发生铝热反应的条件为高温,说明该反应需吸收能量 |
B.反应 在高温时才能自发进行,说明该反应熵变 在高温时才能自发进行,说明该反应熵变 |
| C.碳酸氢钠稀溶液与稀盐酸混合后溶液温度降低,说明该反应需吸收能量 |
| D.某浓度碳酸钠溶液升温时pH减小,说明水的电离程度比碳酸根离子的水解程度增大得更多 |
您最近一年使用:0次
2024-03-12更新
|
38次组卷
|
2卷引用:浙江省强基联盟2023-2024学年高二上学期12月月考化学试题
5 . Si是良好的半导体材料,在科技材料、电子产品等诸多领域都有重要的应用,制备高纯硅时发生主要反应有SiO2(s )+ 2C(s) = Si(s) +2CO(g) ΔH >0 ,关于该反应的自发进行描述正确 的是
| A.高温自发 | B.低温自发 | C.任意温度自发 | D.任意温度都不自发 |
您最近一年使用:0次
名校
6 . 下列叙述正确的是
| A.稀醋酸中加少量醋酸钠能增大醋酸的电离程度 |
B.25℃时,将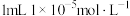 盐酸稀释至1000mL,所得溶液的pH为8 盐酸稀释至1000mL,所得溶液的pH为8 |
| C.蔗糖在水中溶解,这是熵增的过程 |
D.0.1molAgCl和0.1molAgI混合后加入1L水中所得溶液中 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
A.一定条件下反应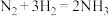 达到平衡时, 达到平衡时,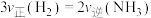 |
B. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的 |
C.室温下, 的 的 溶液与 溶液与 的 的 溶液等体积混合,溶液 溶液等体积混合,溶液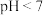 |
D.对于乙酸与乙醇的酯化反应( ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
您最近一年使用:0次
2024-03-10更新
|
177次组卷
|
2卷引用:江苏省南京师范大学附属中学2023-2024学年高二上学期 期末考试化学试卷
解题方法
8 . 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。下列有关合成氨反应的说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol。下列有关合成氨反应的说法正确的是
 2NH3(g) ΔH=-92.4 kJ/mol。下列有关合成氨反应的说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol。下列有关合成氨反应的说法正确的是| A.高温条件下该反应可以自发 |
| B.反应的ΔH=E(N-N)+3E(H-H)-6E(N-H) (E表示键能) |
| C.反应中每消耗1 mol H2转移电子的数目约等于2×6.02×1023 |
| D.该反应采用高温高压条件是为了增大H2的平衡转化率 |
您最近一年使用:0次
解题方法
9 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以 为催化剂,可使
为催化剂,可使 在温和条件下转化为甲醇,反应历程如图所示。
在温和条件下转化为甲醇,反应历程如图所示。 与
与 在活化后的催化剂表面发生可逆反应,每生成1mol
在活化后的催化剂表面发生可逆反应,每生成1mol 放热49.3kJ。
放热49.3kJ。
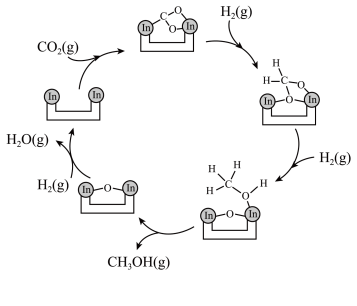
下列说法错误的是
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以 为催化剂,可使
为催化剂,可使 在温和条件下转化为甲醇,反应历程如图所示。
在温和条件下转化为甲醇,反应历程如图所示。 与
与 在活化后的催化剂表面发生可逆反应,每生成1mol
在活化后的催化剂表面发生可逆反应,每生成1mol 放热49.3kJ。
放热49.3kJ。
下列说法错误的是
A.该反应的 |
B.该反应的平衡常数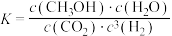 |
C.向容器中充入1mol 和足量 和足量 后,在催化剂存在下充分反应放热49.3kJ 后,在催化剂存在下充分反应放热49.3kJ |
D.该反应中每消耗1molCO2转移电子数为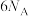 |
您最近一年使用:0次
2024-03-07更新
|
71次组卷
|
2卷引用:河南省焦作市2023-2024学年高二上学期1月期末化学试题
10 . 在常温常压下,下列属于自发过程的是
A. |
B.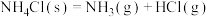 |
C.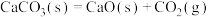 |
D.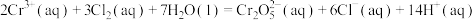 |
您最近一年使用:0次
2024-03-07更新
|
57次组卷
|
2卷引用:湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题



