1 . 已知:空间位阻越大,离去越容易。2-溴-2-甲基丙烷(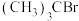 )发生水解反应[
)发生水解反应[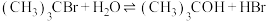 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
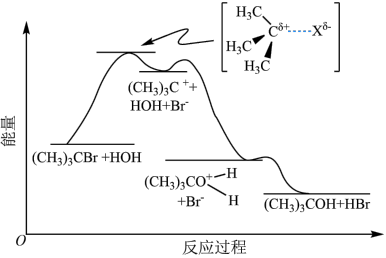
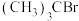 )发生水解反应[
)发生水解反应[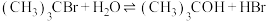 ]的能量变化与反应过程的关系如图所示。下列说法不正确的是
]的能量变化与反应过程的关系如图所示。下列说法不正确的是
| A.该反应在低温下自发进行 |
B.碘原子半径比氧大,因此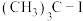 水解生成 水解生成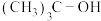 的速率比 的速率比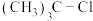 快 快 |
| C.升高温度,可能加快反应速率,同时提高2-溴-2甲基丙烷的平衡转化率 |
D.为了提高2-溴-2-甲基丙烷的水解程度,可以加入适量 固体 固体 |
您最近一年使用:0次
名校
2 . 某小组学生用如图所示简易量热计进行中和反应反应热的测定。近似处理实验所用酸、碱溶液的密度为1.0 g∙cm-3、比热容为4.2J/(g∙℃),忽略量热计的比热容。
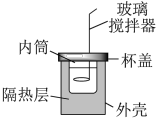
【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
(1)从实验装置上看,还缺少的仪器名称是___________ 。
(2)学生甲实测数据处理
①∆t=___________ ℃。
②放出的热量Q甲___________ kJ(保留一位数)。
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是___________ (写一条)。
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙___________ Q甲(填“<”或“=”或“>”)。
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)___________ 。
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为___________ kJ·mol-1,Kp=___________ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是___________ 。
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是___________ 。

【药品】:50mL 0.50mol/L 盐酸、50mL 0.55mol/L NaOH溶液、50mL 0.55mol/L KOH溶液。
【实验数据】学生甲进行的三次实验数据如下表所示:
| 实验次数 | 反应前体系的温度/℃ | 反应后体系温度/℃ | 温度差平均值/℃ | ||
| 50mL 0.50mol/L盐酸 | 50mL 0.55mol/L NaOH溶液 | 平均值 | |||
| 1 | 24.9 | 25.1 | 28.4 | ∆t | |
| 2 | 25.1 | 25.0 | 26.3 | ||
| 3 | 25.0 | 25.0 | 28.4 | ||
(1)从实验装置上看,还缺少的仪器名称是
(2)学生甲实测数据处理
①∆t=
②放出的热量Q甲
③Q甲kJ比该反应理论上放热为Q kJ略微偏小,其原因可能是
(3)学生乙选用KOH溶液,其他均与学生甲同,且操作规范,预测实验放出热量的数值Q乙
(4)写出上面实验理论上生成1mol H2O时,中和反应的反应热的热化学方程式为(用含Q的代数式表示)
(5)TiO2转化为TiCl4有直接氯化法和碳氯化法。1000 ℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的ΔH为
②碳氯化的反应趋势远大于直接氯化,其原因是
③数据显示在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
④TiO2碳氯化是一个“气-固-固”反应,有利于TiO2-C“固-固”接触的措施是
您最近一年使用:0次
3 . 证据推理是化学学科重要核心素养。下列证据能得出相应推论的是
| 选项 | 证据 | 推论 |
| A | 反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)能自发进行 C2H4(g)+4H2O(g)能自发进行 | 该反应的△H<0 |
| B | 增大压强,化学反应速率加快 | 增大压强,活化分子百分数增多,有效碰撞概率增大 |
| C | 用pH计测定浓度相等的NaClO溶液和Na2CO3溶液的pH,NaClO溶液碱性更强 | 酸性:H2CO3>HClO |
| D | 向双氧水中滴加浓硫酸,产生气体的速率加快 | 浓硫酸对H2O2的分解具有催化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . “节能减排”和“低碳经济”的一项重要课题就是如何将 转化为可利用的资源。
转化为可利用的资源。
Ⅰ.目前工业上有一种方法是用 来生产燃料甲醇。
来生产燃料甲醇。
已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol 、
、 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol
反应①:
 kJ⋅mol
kJ⋅mol
反应②:
 kJ⋅mol
kJ⋅mol
反应③:

(1)


(2)恒温条件下,在某恒容密闭容器中;按照
 投料发生反应③,测得
投料发生反应③,测得 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。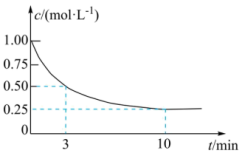
①从反应开始到3 min, 的平均反应速率
的平均反应速率
 ⋅min
⋅min ;试在图中绘制出
;试在图中绘制出 的浓度随时间变化的图像
的浓度随时间变化的图像
②该反应的平衡常数
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
Ⅰ.降低温度,CO的平衡转化率
Ⅱ.向平衡体系中通入惰性气体,平衡
您最近一年使用:0次
5 . 已知: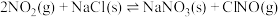
 ,下列说法正确的是
,下列说法正确的是
A.该反应的平衡常数可表达为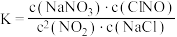 |
| B.该反应一定能自发进行 |
C.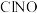 分子的VSEPR模型名称为平面三角形 分子的VSEPR模型名称为平面三角形 |
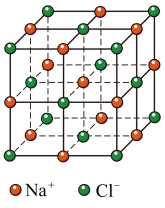
D. 晶胞(如图所示)中每个 晶胞(如图所示)中每个 周围与其距离最近的 周围与其距离最近的 有12个 有12个 |
您最近一年使用:0次
解题方法
6 . 某反应的反应机理、能量与反应进程的关系如下图所示,下列说法正确的是
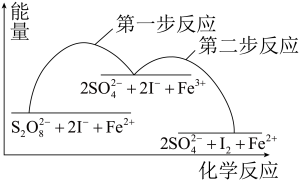

A. 是该反应的催化剂 是该反应的催化剂 | B.该反应焓变 <0可知,该反应可自发进行 <0可知,该反应可自发进行 |
C.加入催化剂后,反应的 变小 变小 | D.第一步反应的活化能比第二步反应的小 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
| A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
| B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
您最近一年使用:0次
8 . 关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛。其化学机理如下:①Hur(尿酸) H++Ur-(尿酸根离子),②Ur-(aq)+Na+(aq)
H++Ur-(尿酸根离子),②Ur-(aq)+Na+(aq) NaUr(s)。下列对反应②的叙述正确的是
NaUr(s)。下列对反应②的叙述正确的是
 H++Ur-(尿酸根离子),②Ur-(aq)+Na+(aq)
H++Ur-(尿酸根离子),②Ur-(aq)+Na+(aq) NaUr(s)。下列对反应②的叙述正确的是
NaUr(s)。下列对反应②的叙述正确的是| A.该反应为熵增的反应 | B.升高温度,平衡向正反应方向移动 |
| C.正反应为放热反应 | D.降低温度,正反应速率减小,逆反应速率增大 |
您最近一年使用:0次
解题方法
9 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: 。
。
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用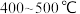 。
。
(3)传统催化剂用的是铁触媒,合成氨反应在 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,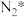 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________ (填步骤前的标号),理由是___________ 。
(i)
(ii)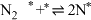
(iii)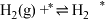
(iv)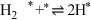
(v)
……
(…)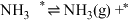
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用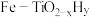 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为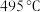 时,
时, 的温度为
的温度为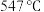 ,而
,而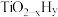 的温度为
的温度为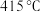 )。
)。

下列说法正确的是___________ 。
a.氨气在“冷 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率
b. 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率
c.“热 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率
d.“冷 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率
(5)方案二: 复合催化剂。
复合催化剂。
下列说法正确的是___________ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为: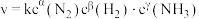 ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
 。
。回答下列问题:
(1)合成氨反应在常温下
(2)
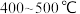 。
。(3)传统催化剂用的是铁触媒,合成氨反应在
 催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,
催化剂上可能通过以下机理进行(*表示催化剂表面吸附位,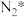 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 )判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
)判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(i)

(ii)
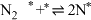
(iii)
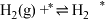
(iv)
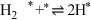
(v)

……
(…)
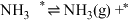
(4)针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案一:双温-双控-双催化剂。使用
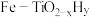 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为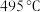 时,
时, 的温度为
的温度为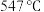 ,而
,而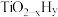 的温度为
的温度为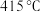 )。
)。
下列说法正确的是
a.氨气在“冷
 ”表面生成,有利于提高氨的平衡产率
”表面生成,有利于提高氨的平衡产率b.
 在“热
在“热 ”表面断裂,有利于提高合成氨反应速率
”表面断裂,有利于提高合成氨反应速率c.“热
 ”高于体系温度,有利于提高氨的平衡产率
”高于体系温度,有利于提高氨的平衡产率d.“冷
 ”低于体系温度,有利于提高合成氨反应速率
”低于体系温度,有利于提高合成氨反应速率(5)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(6)某合成氨速率方程为:
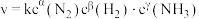 ,根据表中数据,
,根据表中数据,
| 实验 | 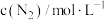 | 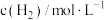 | 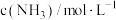 |  |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
您最近一年使用:0次
解题方法
10 . 氯及其化合物在工业生产中具有很重要的作用。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:_______ 。制得的 中有大量的
中有大量的 气体,通入饱和食盐水可除去
气体,通入饱和食盐水可除去 ,且溶液中有白色固体产生,这个固体是
,且溶液中有白色固体产生,这个固体是_______ (填化学式)。
(2) 可用于生产一种化工产品
可用于生产一种化工产品 。已知有关反应如下:
。已知有关反应如下:
①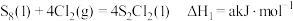
②
③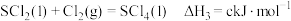
④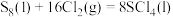
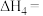
_______  (用含
(用含 和
和 的式子表示)。已知
的式子表示)。已知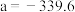 ,则反应①
,则反应①_______ (填字母)
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
(3) 还可在工业上用于生产亚硝酰氯:
还可在工业上用于生产亚硝酰氯: 。
。 时,在
时,在 密闭容器中充入
密闭容器中充入
 与
与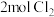 ,一段时间后反应达到平衡。
,一段时间后反应达到平衡。
①该反应达到化学平衡的标志有_______ (填字母)。
A.单位时间内消耗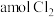 的同时,生成
的同时,生成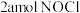
B.容器内总压强不再变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
E.NO与NOCl的体积分数相等
②已知上述反应中正、逆反应速率的表达式为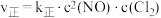 、
、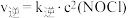 ,
, 、
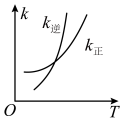
、 变化如图所示,则该反应
变化如图所示,则该反应
_______ 0(填“>”、“<”)。 时,
时, 平衡转化率为
平衡转化率为 ,则
,则 与
与 的比值为
的比值为_______ 。
③若在温度为 ,容积为
,容积为 的容器中,充入
的容器中,充入 、
、 、
、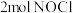 ,则
,则
_______  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(4)氯气—铝电池是一种新型的燃料电池,若电解质溶液为 溶液,电极分别用铝条和碳棒,负极反应为
溶液,电极分别用铝条和碳棒,负极反应为_______ 。
(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:
 中有大量的
中有大量的 气体,通入饱和食盐水可除去
气体,通入饱和食盐水可除去 ,且溶液中有白色固体产生,这个固体是
,且溶液中有白色固体产生,这个固体是(2)
 可用于生产一种化工产品
可用于生产一种化工产品 。已知有关反应如下:
。已知有关反应如下:①
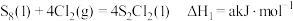
②

③
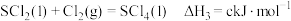
④
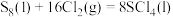
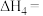
 (用含
(用含 和
和 的式子表示)。已知
的式子表示)。已知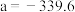 ,则反应①
,则反应①A.一定自发 B.一定不自发 C.高温自发 D.低温自发
(3)
 还可在工业上用于生产亚硝酰氯:
还可在工业上用于生产亚硝酰氯: 。
。 时,在
时,在 密闭容器中充入
密闭容器中充入
 与
与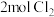 ,一段时间后反应达到平衡。
,一段时间后反应达到平衡。①该反应达到化学平衡的标志有
A.单位时间内消耗
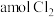 的同时,生成
的同时,生成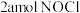
B.容器内总压强不再变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
E.NO与NOCl的体积分数相等
②已知上述反应中正、逆反应速率的表达式为
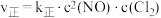 、
、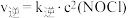 ,
, 、
、 变化如图所示,则该反应
变化如图所示,则该反应
 时,
时, 平衡转化率为
平衡转化率为 ,则
,则 与
与 的比值为
的比值为
③若在温度为
 ,容积为
,容积为 的容器中,充入
的容器中,充入 、
、 、
、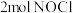 ,则
,则
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(4)氯气—铝电池是一种新型的燃料电池,若电解质溶液为
 溶液,电极分别用铝条和碳棒,负极反应为
溶液,电极分别用铝条和碳棒,负极反应为
您最近一年使用:0次



