名校
解题方法
1 . 下列说法正确的是
A.25℃时,0.1 的醋酸溶液加水稀释,所有离子的浓度均减小 的醋酸溶液加水稀释,所有离子的浓度均减小 |
B.保持温度不变,向稀氨水中缓慢通入 ,溶液中 ,溶液中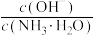 的值减少 的值减少 |
C.反应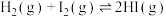 达平衡时,将容积缩小一半,混合气体颜色不变 达平衡时,将容积缩小一半,混合气体颜色不变 |
D.反应 在一定条件下能自发进行,该反应一定为放热反应 在一定条件下能自发进行,该反应一定为放热反应 |
您最近一年使用:0次
名校
2 . 由铁及其化合物可制得FeSO4·7H2O、FeCl3、K2FeO4等化工产品,它们在生产、生活中具有 广泛应用。高炉炼铁的反应为 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1,对于该反应下列有关说法正确的是
2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1,对于该反应下列有关说法正确的是
 2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1,对于该反应下列有关说法正确的是
2Fe(s)+3CO2(g) ΔH=-23.5 kJ·mol-1,对于该反应下列有关说法正确的是| A.若该反应一定能自发进行,则该反应的ΔS>0 |
| B.升高温度使反应物活化分子数增多,能提高反应速率和CO平衡转化率 |
| C.增加炼铁炉高度,延长CO和铁矿石接触时间,能降低平衡时尾气中CO的体积分数 |
| D.制备的生铁中含少量FexC,相同条件下与酸反应放出氢气的速率比纯铁快 |
您最近一年使用:0次
解题方法
3 . 下列说法正确的是
A.反应N2+3H2 2NH3的△H<0,△S>0 2NH3的△H<0,△S>0 |
| B.反应2CO(g)+2NO(g)=N2(g)+2CO2(g) △H>0在常温下能自发进行 |
| C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)的△H<0,则该反应能在高温自发进行 |
| D.反应C(s)+CO2(g)=2CO(g)常温下不能自发进行,则该反应的△H>0 |
您最近一年使用:0次
解题方法
4 . 合成气(CO+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1
①判断该反应的自发性条件___________ ;
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g) CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是___________ 。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
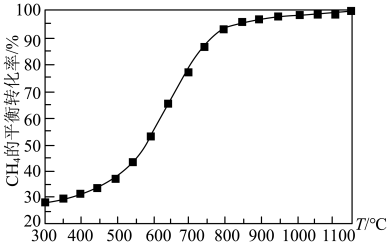
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线________ 。
②现有实验测得反应2CH4(g)+O2(g) 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
最佳碳氧比[n(CH4)/n(O2)]为___________ 。
(1)煤化工中生产合成气的反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.5kJ·mol-1
CO(g)+H2(g) ΔH=+131.5kJ·mol-1①判断该反应的自发性条件
②在恒温恒容下,同时放入C(s)、H2O(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H2O(g)
 CO(g)+H2(g)已达到平衡的是
CO(g)+H2(g)已达到平衡的是A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH—O键断裂的同时有1molH—H键断裂
D.混合气体的平均相对分子质量保持不变
(2)天然气化工中生产合成气的主要反应为:2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
2CO(g)+4H2(g) ΔH=akJ·mol-1,在恒容容器中按物质的量之比1︰2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
①请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线
②现有实验测得反应2CH4(g)+O2(g)
 2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)
2CO(g)+4H2(g)在750℃下,以不同碳氧比[n(CH4)/n(O2)]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示。(已知:选择性=目标产物的产率/反应原料的转化率)| 碳氧比[n(CH4)/n(O2)] | 1︰0.25 | 1︰0.5 | 1︰1 | 1︰1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
您最近一年使用:0次
解题方法
5 .  的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
反应①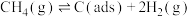

反应②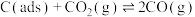

有关物质的相对能量与反应历程的变化如图所示[ 为吸附性活性炭]:
为吸附性活性炭]:
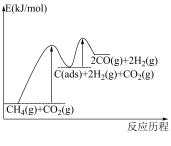
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
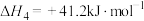
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

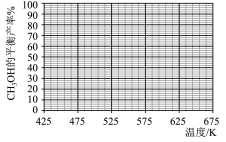
(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
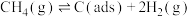

反应②
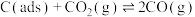

有关物质的相对能量与反应历程的变化如图所示[
 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

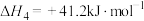
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近一年使用:0次
解题方法
6 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①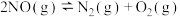
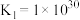
②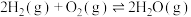
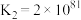
③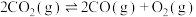
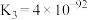
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: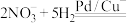

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: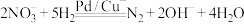 的
的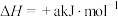 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
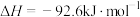 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,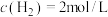 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.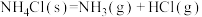 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果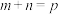 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
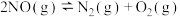
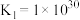
②
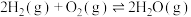
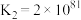
③
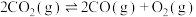
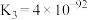
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为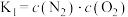 |
B.该温度下,反应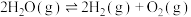 的平衡常数的数值约为 的平衡常数的数值约为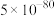 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: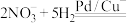

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
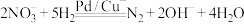 的
的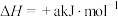 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

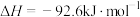 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K | 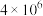 |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,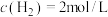 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次
解题方法
7 . 研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是
A. <0、 <0、 >0的反应在温度低时不能自发进行 >0的反应在温度低时不能自发进行 |
| B.在其他外界条件不变的情况下,汽车排气管中使用催化剂可以改变产生尾气的反应方向 |
| C.冰在室温下自动熔化成水是一个熵增的过程 |
D.一定温度下,反应MgCl2(1) Mg(1)+Cl2(g)的 Mg(1)+Cl2(g)的 <0、 <0、 >0 >0 |
您最近一年使用:0次
8 . 已知反应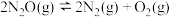 的势能曲线示意图如下(…表示吸附作用,A表示催化剂,
的势能曲线示意图如下(…表示吸附作用,A表示催化剂, 表示过渡态分子):
表示过渡态分子):
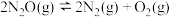 的势能曲线示意图如下(…表示吸附作用,A表示催化剂,
的势能曲线示意图如下(…表示吸附作用,A表示催化剂, 表示过渡态分子):
表示过渡态分子):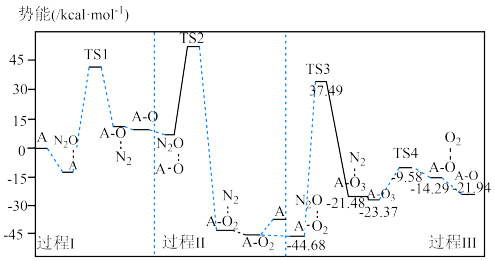
A.过程Ⅰ、Ⅱ、Ⅲ中都有 生成 生成 |
| B.若在任意温度下均能自发进行,则反应为吸热反应 |
C.该反应中只有两种物质能够吸附 分子 分子 |
D.过程Ⅲ中最大势能垒(活化能)为 |
您最近一年使用:0次
2024-04-01更新
|
204次组卷
|
3卷引用:江西省宜春市丰城市第九中学2023-2024学年高二下学期4月期中考试化学试题
江西省宜春市丰城市第九中学2023-2024学年高二下学期4月期中考试化学试题江西省九江市十校2024届高三第二次联考化学试题(已下线)压轴题04?化学反应机理、历程、能垒图分析(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
9 . 下列有关说法正确的是
| A.回收处理废旧电池,主要是为了变废为宝 |
| B.在化学工业中,选用催化剂一定能提高经济效益 |
C.反应 在室温下可自发进行,则该反应的 在室温下可自发进行,则该反应的 |
| D.可用pH试纸测定新制氯水的pH,但是不能用蒸馏水将pH试纸事先润湿 |
您最近一年使用:0次
10 . 化学反应伴随着能量变化,研究化学反应中的能量变化具有重大意义。请回答下列问题:
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:
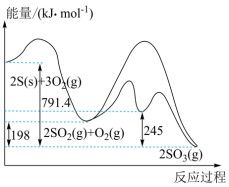
(1)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为______ 。
(2)对于反应 :
:
①______ (填“低温”、“高温”或“任意温度”)有利于该反应正向自发进行。
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是______ (填标号)。
A.升高温度 B.压缩容器体积 C.增大 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
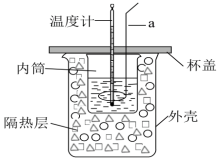
实验步骤:
①量取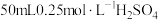 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;
②量取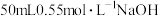 溶液,测量温度;
溶液,测量温度;
③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为______ ,使用的溶液稍微过量的原因是______ 。
(4)实验数据记录:
(5)实验过程中,向 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
______ (填“偏大”或“偏小”,下同);若用 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
______ 。
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:

(1)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)对于反应
 :
:①
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是
A.升高温度 B.压缩容器体积 C.增大
 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

实验步骤:
①量取
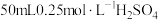 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;②量取
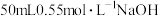 溶液,测量温度;
溶液,测量温度;③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为
(4)实验数据记录:
实验次数 | 反应物的初始温度/℃ | 反应后体系的温度/℃ | ||
H2SO4溶液 | NaOH溶液 | 平均值 | ||
1 | 25.2 | 25.4 | 28.6 | |
2 | 24.9 | 25.1 | 28.4 | |
3 | 25.3 | 25.3 | 28.0 | |
4 | 25.0 | 25.2 | 28.3 | |
设实验所用的酸、碱溶液的密度均为 ,反应前后溶液的比热容
,反应前后溶液的比热容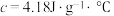 。计算该实验的
。计算该实验的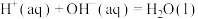

 。
。
(5)实验过程中,向
 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
您最近一年使用:0次



