1 . 常温下,向含 、
、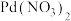 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中 [
[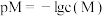 ,
,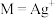 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
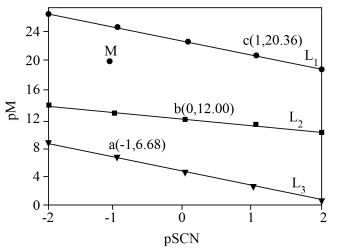
的关系如图所示。已知:常温下,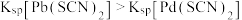 ,平衡常数K大于
,平衡常数K大于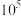 时认为该反应能完全进行。
时认为该反应能完全进行。
下列叙述错误的是
 、
、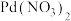 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中 [
[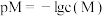 ,
,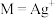 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
的关系如图所示。已知:常温下,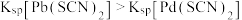 ,平衡常数K大于
,平衡常数K大于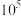 时认为该反应能完全进行。
时认为该反应能完全进行。
下列叙述错误的是
A.直线 代表pPd与pSCN的关系 代表pPd与pSCN的关系 |
B.饱和AgSCN溶液中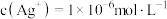 |
C.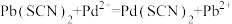 不可逆 不可逆 |
D.M点溶液可析出AgSCN和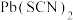 |
您最近一年使用:0次
2024-03-10更新
|
247次组卷
|
2卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
名校
2 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:

已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: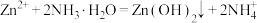 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
(1)已知 中
中 采用
采用 杂化,则
杂化,则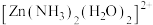 有
有___________ 种结构。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的___________ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是___________ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为___________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是___________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为___________ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫___________ 。
(6)通常认为离子浓度 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
___________ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: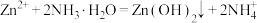 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
 中
中 采用
采用 杂化,则
杂化,则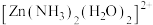 有
有(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
您最近一年使用:0次
名校
解题方法
3 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
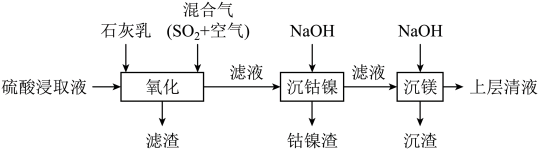
已知:
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为___________ 。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为:___________ ;得到滤渣的主要成分为 、
、___________ (填化学式)。
(3)“沉钴镍”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(4)“沉镁”中为使 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于___________ (精确至0.1)。
(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
(6) 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  |  |  | 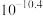 |
(1)基态Co原子的价层电子轨道表示式为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知
 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为: 、
、(3)“沉钴镍”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:(4)“沉镁”中为使
 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
| A.粉碎矿渣、升高温度均可以提高“溶浸”率 |
B.通过高温焙烧可以将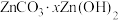 制得氧化锌 制得氧化锌 |
C.根据 中S的化合价分析, 中S的化合价分析, 具有强还原性 具有强还原性 |
D. 可与浓盐酸反应生成 可与浓盐酸反应生成 , , 参与反应可生成 参与反应可生成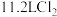 |
(6)
 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是
您最近一年使用:0次
名校
解题方法
4 . 灵感是在劳动时候产生的。下列劳动项目涉及反应的离子方程式书写正确的是
A.用铝和氢氧化钠作管道疏通剂: |
B.用醋酸洗涤铜锣上的铜绿: |
C.用石膏改良盐碱地: |
D.用热的纯碱溶液除去盘碟油污: |
您最近一年使用:0次
名校
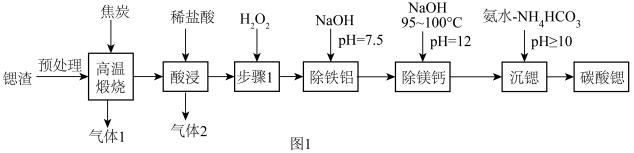
5 . 碳酸锶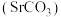 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
,含少量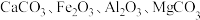 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
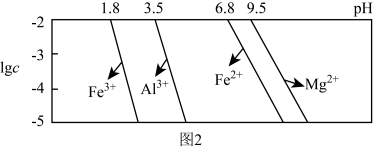
已知:①室温下,溶液中金属离子物质的量浓度 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
② 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:
回答下列问题:
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为____________ 。
(2)“步骤1”的目的是____________ 。
(3)“除铁铝”后溶液温度降至室温,溶液中 为
为______  。
。
(4)“除镁钙”过程温度控制在95~100℃的目的是_____________________________________________ 。
(5)“沉锶”的离子反应方程式为_________________________ 。
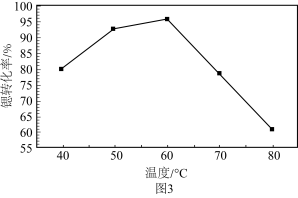
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为_____________________________________
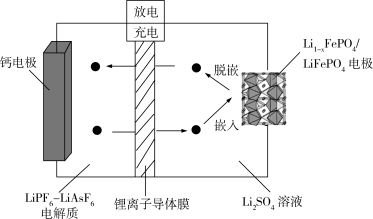
(7)如图为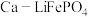 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为______ (“阳极”或“阴极”),放电时,正极上发生 的嵌入的电极反应是
的嵌入的电极反应是______ 。
 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
,含少量 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①室温下,溶液中金属离子物质的量浓度
 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
②
 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为
(2)“步骤1”的目的是
(3)“除铁铝”后溶液温度降至室温,溶液中
 为
为 。
。(4)“除镁钙”过程温度控制在95~100℃的目的是
(5)“沉锶”的离子反应方程式为
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为

(7)如图为
 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为 的嵌入的电极反应是
的嵌入的电极反应是
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验操作和现象能得出相应实验结论的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 往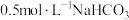 溶液中加入盐酸,将产生的气体通入 溶液中加入盐酸,将产生的气体通入 溶液中, 溶液中, 溶液中有沉淀生成 溶液中有沉淀生成 | 非金属性: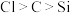 |
| B | 向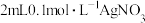 溶液中先滴加4滴 溶液中先滴加4滴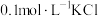 溶液,再滴加4滴 溶液,再滴加4滴 溶液,先产生白色沉淀,再产生黄色沉淀 溶液,先产生白色沉淀,再产生黄色沉淀 |  |
| C | 以 为电极,以酸化的 为电极,以酸化的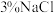 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 电极区域少量溶液于试管中,滴入2滴 电极区域少量溶液于试管中,滴入2滴 溶液,未出现蓝色沉淀 溶液,未出现蓝色沉淀 | 牺牲阳极法保护金属 |
| D | 用 试纸分别测定饱和的 试纸分别测定饱和的 溶液和 溶液和 溶液, 溶液, 依次为9和8 依次为9和8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有___________ (写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、___________ ,“浸出液”调节pH的范围为___________ ,调节pH选用的试剂可以是___________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为___________ 。
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是___________ 。
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于___________ mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式:___________ {已知:Ksp[Co(OH)2]=2×10-15};
(6)由“母液4”获取NiSO4·7H2O的操作是___________ 、___________ 、过滤、洗涤。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有
(2)沉淀A的主要成分是Fe(OH)3、
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于
(6)由“母液4”获取NiSO4·7H2O的操作是
您最近一年使用:0次
名校
解题方法
8 . 工业生产中利用方铅矿(主要成分为 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: ;
; ,
,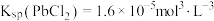 。
。
下列说法错误的是
 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: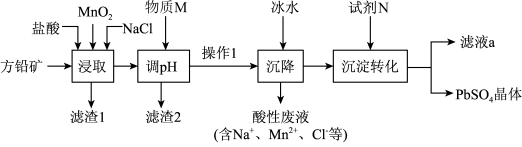
 ;
; ,
,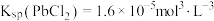 。
。下列说法错误的是
A.“浸取”时发生反应: |
B.物质M可以为 ,试剂N可以为 ,试剂N可以为 |
C.由该工艺可知, 反应放热 反应放热 |
D.“沉淀转化”过程达平衡时,溶液中 |
您最近一年使用:0次
2024-03-01更新
|
756次组卷
|
3卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟考卷(二)化学试题
名校
解题方法
9 . 下列有关电极方程式或离子方程式错误的是
A.碳酸银粉末加入到稀盐酸中: |
B.用醋酸滴定氨水: |
C.葡萄糖与新制氢氧化铜反应: |
D.铅酸蓄电池放电时正极反应: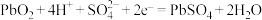 |
您最近一年使用:0次
2024-02-26更新
|
193次组卷
|
3卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
10 . 常温下,分别在 、
、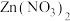 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 [
[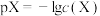 ,X代表
,X代表 、
、 、
、 ,
, ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: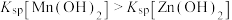 。下列叙述错误的是
。下列叙述错误的是
 、
、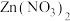 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 [
[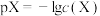 ,X代表
,X代表 、
、 、
、 ,
, ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: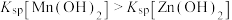 。下列叙述错误的是
。下列叙述错误的是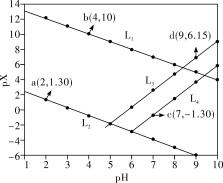
A.图中 代表 代表 , , 代表 代表 |
B.室温下,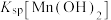 的数量级为 的数量级为 |
C.同时产生两种沉淀时,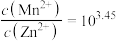 |
D. 、 、 均能溶于亚硝酸溶液 均能溶于亚硝酸溶液 |
您最近一年使用:0次
2024-02-26更新
|
237次组卷
|
2卷引用: 湖南师范大学附属中学2023-2024学年高三下学期第六次月考化学试题



