1 . 氟化学在现代无机化学中占有相当重要的地位。
(1)1670年,德国人斯瓦恩哈德无意中将萤石( )与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为
)与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为___________ 。
(2)单质氟的制备是化学史上一段悲壮的历史,直到1886年法国化学家莫瓦桑电解熔融的氟化氢钾(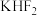 )才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为
)才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为___________ 。
(3)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
分压=总压×该组分物质的量分数,对于反应
 ,其中
,其中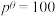 kPa,
kPa,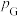 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
下图是以0.125 mol/L Xe和1.225 mol/L 为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
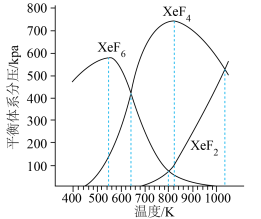
①制备 的适宜温度约为
的适宜温度约为___________ K。
②523K时,以Xe和 制取
制取 。反应达到平衡时,欲使产物中
。反应达到平衡时,欲使产物中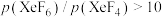 ,
,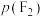 至少应保持在
至少应保持在___________ kPa。
③反应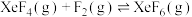 的
的
___________ 0,(填“大于”“等于”或“小于”),简述理由为___________ 。
(4)法国科学家盖•吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,却意外地制成了一种所谓的“氟酸气”( )。已知:
)。已知: ,其中
,其中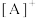 为含多个卤素原子的阳离子,
为含多个卤素原子的阳离子, 为一个正四面体结构的阴离子,则
为一个正四面体结构的阴离子,则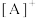 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
(5)已知: ,若向1 L 0.1 mol/L的
,若向1 L 0.1 mol/L的 溶液中加入NaF固体,充分反应后,测得溶液中
溶液中加入NaF固体,充分反应后,测得溶液中 浓度为
浓度为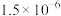 mol/L,则加入的NaF固体的质量为
mol/L,则加入的NaF固体的质量为___________ g。(忽略加入固体后溶液体积的变化,计算结果保留 2 位小数 )
(1)1670年,德国人斯瓦恩哈德无意中将萤石(
 )与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为
)与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为(2)单质氟的制备是化学史上一段悲壮的历史,直到1886年法国化学家莫瓦桑电解熔融的氟化氢钾(
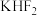 )才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为
)才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为(3)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
| 反应方程式 | 标准平衡常数 | |
| 523K | 673K | |
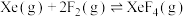 |  | 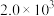 |
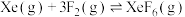 |  | 36.0 |

 ,其中
,其中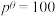 kPa,
kPa,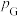 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。下图是以0.125 mol/L Xe和1.225 mol/L
 为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
①制备
 的适宜温度约为
的适宜温度约为②523K时,以Xe和
 制取
制取 。反应达到平衡时,欲使产物中
。反应达到平衡时,欲使产物中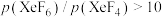 ,
,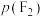 至少应保持在
至少应保持在③反应
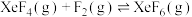 的
的
(4)法国科学家盖•吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,却意外地制成了一种所谓的“氟酸气”(
 )。已知:
)。已知: ,其中
,其中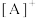 为含多个卤素原子的阳离子,
为含多个卤素原子的阳离子, 为一个正四面体结构的阴离子,则
为一个正四面体结构的阴离子,则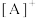 的VSEPR模型名称为
的VSEPR模型名称为(5)已知:
 ,若向1 L 0.1 mol/L的
,若向1 L 0.1 mol/L的 溶液中加入NaF固体,充分反应后,测得溶液中
溶液中加入NaF固体,充分反应后,测得溶液中 浓度为
浓度为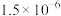 mol/L,则加入的NaF固体的质量为
mol/L,则加入的NaF固体的质量为
您最近一年使用:0次
2 . 由下列实验操作及现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 溶液分层,下层呈紫红色 | 氧化性: |
B | 用玻璃棒蘸取待测溶液置于火焰上灼烧 | 火焰呈黄色 | 溶液中含Na元素 |
C | 用pH计测定下列溶液的pH:① | pH:①>② |
|
D | 向浓度均为 | 出现黄色沉淀 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
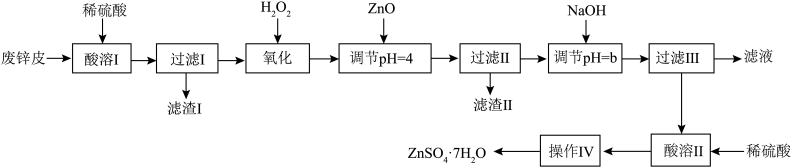
3 . 按如下工艺流程以废旧锌锰干电池的外壳锌皮(含有少量Fe、ZnCl2、MnO2等杂质)为原料制取皓矾(ZnSO4·7H2O)。
已知:①Ksp[Zn(OH)2]=1.0×10-17,当pH≥12.0时,Zn(OH)2开始转化为 而溶解。
而溶解。
②金属氢氧化物沉淀的pH:
请回答下列问题:
(1)“酸溶I”时,为了提高酸溶速率,可采取的措施有:___________ (任答两点),“滤渣I”的主要成分是___________ 。
(2)“氧化”时,酸性滤液中加入H2O2反应的离子方程式为___________ ,可用NaNO2代替H2O2,但缺点是___________ 。
(3)常温下,加入NaOH调pH=b,b的取值范围是___________ ,若“滤液”的pH=6,则溶液中残留的c(Zn2+)=___________ mol/L。
(4)“操作Ⅳ”的具体操作是___________ ,过滤,洗涤,干燥。

已知:①Ksp[Zn(OH)2]=1.0×10-17,当pH≥12.0时,Zn(OH)2开始转化为
 而溶解。
而溶解。②金属氢氧化物沉淀的pH:
| 氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
| Zn(OH)2 | 5.7 | 8.0 |
| Fe(OH)3 | 2.7 | 3.7 |
(1)“酸溶I”时,为了提高酸溶速率,可采取的措施有:
(2)“氧化”时,酸性滤液中加入H2O2反应的离子方程式为
(3)常温下,加入NaOH调pH=b,b的取值范围是
(4)“操作Ⅳ”的具体操作是
您最近一年使用:0次
名校
解题方法
4 . 下列实验方案能达到实验目的的是

A.方案甲可制取无水 | B.方案乙可除去 溶液中部分的 溶液中部分的 |
C.方案丙可验证非金属性: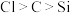 | D.方案丁可判断溶度积: |
您最近一年使用:0次
2024-03-26更新
|
473次组卷
|
3卷引用:湖南省长沙市2024届高三新高考适应性考试化学试题
湖南省长沙市2024届高三新高考适应性考试化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届天津市第四十七中学高三下学期模拟预测化学试题
5 . 难溶盐 可溶于盐酸,常温下,用盐酸调节
可溶于盐酸,常温下,用盐酸调节 浊液的pH,测得体系中
浊液的pH,测得体系中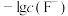 或
或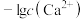 与
与 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
 可溶于盐酸,常温下,用盐酸调节
可溶于盐酸,常温下,用盐酸调节 浊液的pH,测得体系中
浊液的pH,测得体系中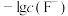 或
或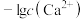 与
与 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是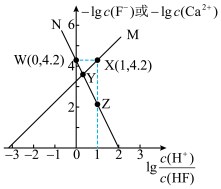
A.随着盐酸的加入,溶液中 和 和 均逐渐增大 均逐渐增大 |
B.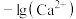 与 与 的关系对应图中曲线M 的关系对应图中曲线M |
C.常温下,难溶盐 的 的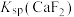 数量级为 数量级为 |
D.Y点的溶液中存在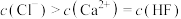 |
您最近一年使用:0次
名校
6 . 菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同 下体系中
下体系中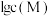 与
与 关系如图所示(
关系如图所示( 代表
代表 ),已知
),已知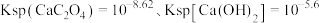 。下列有关说法正确的是
。下列有关说法正确的是
 下体系中
下体系中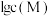 与
与 关系如图所示(
关系如图所示( 代表
代表 ),已知
),已知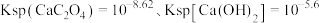 。下列有关说法正确的是
。下列有关说法正确的是
A.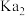 数量级为 数量级为 |
B.溶液 时, 时,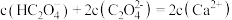 |
C. 时,曲线①呈上升趋势的原因是部分 时,曲线①呈上升趋势的原因是部分 转化为 转化为 |
D. 点时,体系中 点时,体系中 |
您最近一年使用:0次
2024-03-22更新
|
1646次组卷
|
11卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题东北三省2023-2024学年高三下学期高考模拟试题(一)湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷湖北省高中名校联盟2023-2024学年高三下学期3月月考化学试题河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题(已下线)化学(北京卷02)-2024年高考押题预测卷(已下线)化学(福建卷01)-2024年高考押题预测卷河北省重点高中2023-2024学年高三下学期第三次模拟化学试题安徽省六安第一中学2024届高三下学期质量检测(二 )化学试题(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题2024届湖北省武汉市黄陂区第七高级中学高三下学期一模化学试题
名校
解题方法
7 . 铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、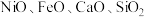 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:
(1)用95℃热水浸泡的目的是________________ ;
(2)矿渣中部分 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是________ ;
(3)向“浸取液”中加入 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为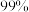 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是________  ;
;
(4)从 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是________ ,过滤,洗涤,干燥;
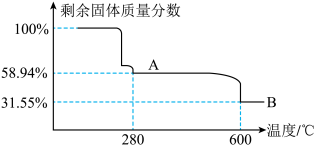
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是________ ;
(6)基态镍离子 的核外最外层电子排布式是
的核外最外层电子排布式是________ ;
(7) 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为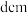 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是________  (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是________  (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
Ⅰ.从某矿渣[成分为
 (铁酸镍)、
(铁酸镍)、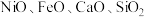 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: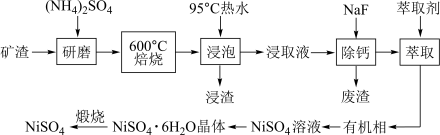
 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:(1)用95℃热水浸泡的目的是
(2)矿渣中部分
 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是(3)向“浸取液”中加入
 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为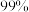 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是 ;
;(4)从
 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
(6)基态镍离子
 的核外最外层电子排布式是
的核外最外层电子排布式是(7)
 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为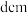 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是 (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是 (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-22更新
|
395次组卷
|
4卷引用:湖南省邵阳市2024届高三二模化学试题
名校
解题方法
8 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。

回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为___________ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素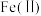 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;再加入石灰乳,所得滤渣中主要成分是 、
、___________ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是___________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是___________ 。

(4)①将“钴镍渣”酸溶后,先加入 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成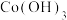 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②若“镍钴分离”后溶液中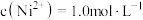 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中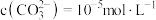 ,则沉镍率=
,则沉镍率=___________ 。[已知: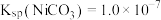 ,沉镍率
,沉镍率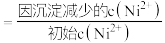 ]
]
 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为
(3)已知:
 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素
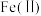 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是
(4)①将“钴镍渣”酸溶后,先加入
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成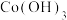 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
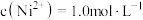 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中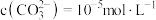 ,则沉镍率=
,则沉镍率=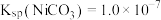 ,沉镍率
,沉镍率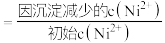 ]
]
您最近一年使用:0次
名校
解题方法
9 . 从宏观现象探究微观本质是重要的化学学科素养。为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是______ 。
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为______ 。
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为______ (填化学式)。两位同学实验如下:
(4)两位同学猜测实验a中的黑色沉淀可能是Fe2S3。继续实验:
根据实验b说明黑色沉淀是Fe2S3,写出实验b中Fe2S3与盐酸反应的化学方程式:______ 。
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为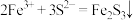 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于______ 。
②实验a中Fe2S3溶解时生成的黄色固体为______ ,乙同学推测是因为随着FeCl3溶液滴加至一定量, 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。
(6)已知: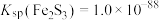 ,
,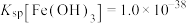 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:______ 。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
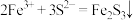 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
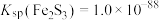 ,
,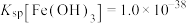 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
您最近一年使用:0次
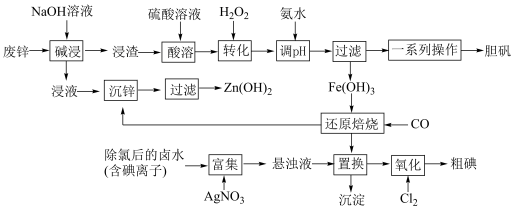
10 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: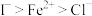
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比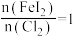 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
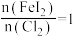 时,氧化产物为
时,氧化产物为
您最近一年使用:0次

 、KI混合溶液中依次加入少量氯水和
、KI混合溶液中依次加入少量氯水和
 溶液;②
溶液;② 溶液
溶液 酸性弱于
酸性弱于
 的
的 和KI混合溶液中滴加少量
和KI混合溶液中滴加少量 溶液
溶液





