名校
解题方法
1 . 常温下,在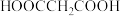 (简记为
(简记为 )和
)和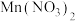 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、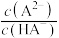 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
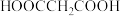 (简记为
(简记为 )和
)和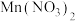 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、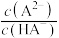 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的关系 的关系 |
B.直线 和 和 的交叉点坐标为 的交叉点坐标为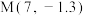 |
C.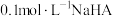 溶液中: 溶液中: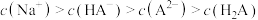 |
D.常温下,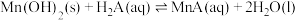 的 的 值为 值为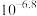 |
您最近一年使用:0次
2024-04-05更新
|
202次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
2 . 向 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应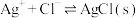 和
和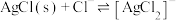 。
。 与
与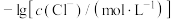 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法错误的是
)。下列说法错误的是

 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应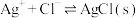 和
和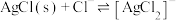 。
。 与
与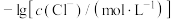 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法错误的是
)。下列说法错误的是
A. 时,溶液中 时,溶液中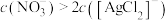 |
B.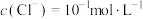 时,溶液中 时,溶液中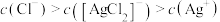 |
C.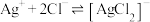 的平衡常数 的平衡常数 的值为 的值为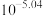 |
D.用 沉淀 沉淀 ,溶液中 ,溶液中 浓度过大时,沉淀效果不好 浓度过大时,沉淀效果不好 |
您最近一年使用:0次
3 . 以 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:
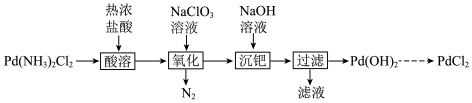
已知:① 具有顺反异构;
具有顺反异构;
②“酸溶”中生成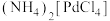 ;
;
③ 有两性,
有两性, ;
;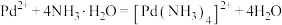
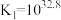 。
。
下列说法不正确的是
 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:
已知:①
 具有顺反异构;
具有顺反异构;②“酸溶”中生成
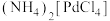 ;
;③
 有两性,
有两性, ;
;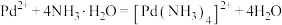
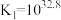 。
。下列说法不正确的是
A. 中的配位体为 中的配位体为 ,Pd的配位数为2 ,Pd的配位数为2 |
B.“氧化”过程中发生反应的离子方程式为: |
C. 的平衡常数 的平衡常数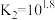 |
D.若氧化不充分,将会导致 的产率降低 的产率降低 |
您最近一年使用:0次
解题方法
4 . 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、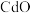 等)为原料制备氧化锌的工艺流程如图所示:
等)为原料制备氧化锌的工艺流程如图所示: 、
、 、
、 ;
;
ⅱ.25℃时相关物质的 如下表:
如下表:
(1) 态核外电子能级共
态核外电子能级共_____ 个。
(2)“氧化预处理”阶段得到的氧化产物有 、
、 ,“氧化预处理”的目的是
,“氧化预处理”的目的是_____ 。
(3)“氨浸”时生成多种配离子,其中生成 的离子方程式为
的离子方程式为_____ 。
(4)已知: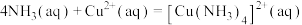
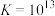 ,则
,则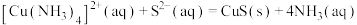 的化学平衡常数
的化学平衡常数 为
为_____ 。
(5)“蒸氨”时得到混合气体e和固体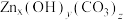 。
。
①混合气体e可返回至_____ 工序循环利用;
②取11.2g固体,经充分“煅烧”后得到氧化锌8.1g,同时产生的气体通入到足量 溶液中,可得沉淀9.85g,则固体
溶液中,可得沉淀9.85g,则固体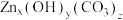 的化学式为
的化学式为_____ 。
(6)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),储罐内 溶解后形成
溶解后形成 离子,电解池中发生总反应的离子方程式为
离子,电解池中发生总反应的离子方程式为_____ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等)为原料制备氧化锌的工艺流程如图所示:
等)为原料制备氧化锌的工艺流程如图所示: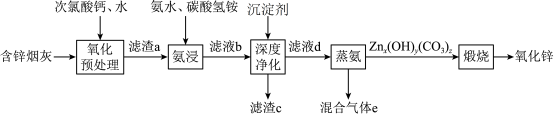
 、
、 、
、 ;
;ⅱ.25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  |  |  |  |
 | 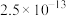 |  |  | 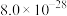 | 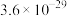 | 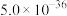 |
(1)
 态核外电子能级共
态核外电子能级共(2)“氧化预处理”阶段得到的氧化产物有
 、
、 ,“氧化预处理”的目的是
,“氧化预处理”的目的是(3)“氨浸”时生成多种配离子,其中生成
 的离子方程式为
的离子方程式为(4)已知:
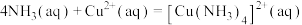
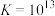 ,则
,则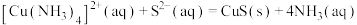 的化学平衡常数
的化学平衡常数 为
为(5)“蒸氨”时得到混合气体e和固体
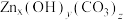 。
。①混合气体e可返回至
②取11.2g固体,经充分“煅烧”后得到氧化锌8.1g,同时产生的气体通入到足量
 溶液中,可得沉淀9.85g,则固体
溶液中,可得沉淀9.85g,则固体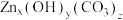 的化学式为
的化学式为(6)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),储罐内
 溶解后形成
溶解后形成 离子,电解池中发生总反应的离子方程式为
离子,电解池中发生总反应的离子方程式为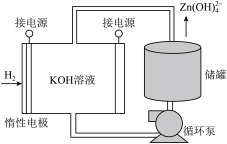
您最近一年使用:0次
名校
5 . 为了探究 的溶度积常数
的溶度积常数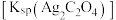 的测定,某兴趣小组设计如下步骤。
的测定,某兴趣小组设计如下步骤。

(1)步骤Ⅰ中需要配制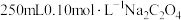 溶液、
溶液、 溶液、
溶液、 标准溶液。
标准溶液。
①配制 溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为
溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为_______ 。
②用 固体配制该溶液时,需要用电子天平称量
固体配制该溶液时,需要用电子天平称量_______ 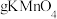 固体(该电子天平称量时可读数到
固体(该电子天平称量时可读数到 )。
)。
(2)用碱性滴定管量取 溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的
溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的 溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化
溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化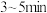 ,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
①量取 溶液时选用碱式滴定管的主要原因为
溶液时选用碱式滴定管的主要原因为_______ (用离子方程式表示)。
②为方便数据处理,“一定体积”最好是_______  。
。
(3)准确量取 所得滤液注入锥形瓶中,加入足量的
所得滤液注入锥形瓶中,加入足量的 的硫酸,用所配
的硫酸,用所配 标准溶液滴定,实验三次,消耗
标准溶液滴定,实验三次,消耗 标准溶液的平均值为
标准溶液的平均值为 (已知:
(已知: )。
)。
①滴定终点现象为_______ 。
②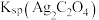 的溶度积测定值为
的溶度积测定值为_______ (用含b的计算式表示)。
③若步骤Ⅱ中烧杯盛接的滤液浑浊,会使测量值___ (填“偏高”“偏低”或“无影响”,下同);若锥形瓶有少量水存在,会使测量值__ 。
 的溶度积常数
的溶度积常数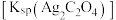 的测定,某兴趣小组设计如下步骤。
的测定,某兴趣小组设计如下步骤。
(1)步骤Ⅰ中需要配制
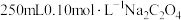 溶液、
溶液、 溶液、
溶液、 标准溶液。
标准溶液。①配制
 溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为
溶液时,选用棕色的容量瓶而不选用普通容量瓶的原因为②用
 固体配制该溶液时,需要用电子天平称量
固体配制该溶液时,需要用电子天平称量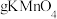 固体(该电子天平称量时可读数到
固体(该电子天平称量时可读数到 )。
)。(2)用碱性滴定管量取
 溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的
溶液于洁净的棕色锥形瓶中,然后用棕色滴定管量取一定体积的 溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化
溶液注入到棕色锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化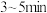 ,用过滤器过滤,滤液用干燥洁净的烧杯盛接。
,用过滤器过滤,滤液用干燥洁净的烧杯盛接。①量取
 溶液时选用碱式滴定管的主要原因为
溶液时选用碱式滴定管的主要原因为②为方便数据处理,“一定体积”最好是
 。
。(3)准确量取
 所得滤液注入锥形瓶中,加入足量的
所得滤液注入锥形瓶中,加入足量的 的硫酸,用所配
的硫酸,用所配 标准溶液滴定,实验三次,消耗
标准溶液滴定,实验三次,消耗 标准溶液的平均值为
标准溶液的平均值为 (已知:
(已知: )。
)。①滴定终点现象为
②
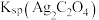 的溶度积测定值为
的溶度积测定值为③若步骤Ⅱ中烧杯盛接的滤液浑浊,会使测量值
您最近一年使用:0次
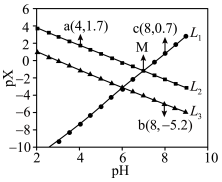
6 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、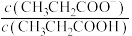 ]的关系如图所示。
]的关系如图所示。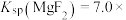
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、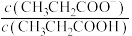 ]的关系如图所示。
]的关系如图所示。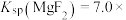
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

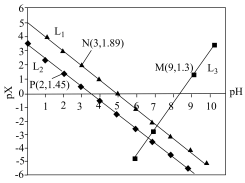
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的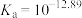 |
C.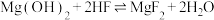 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
587次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期4月期中考试化学试题
解题方法
7 . 下列实验设计能达到对应实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 检验溶液中是否含 | 在待测液中滴加 溶液,观察是否出现特征蓝色沉淀 溶液,观察是否出现特征蓝色沉淀 |
| B | 检验含碘食盐中存在碘元素 | 在含碘食盐溶液中加入淀粉溶液,再滴加稀硝酸,观察溶液是否变蓝 |
| C | 验证溶度积: | 在2mL 0.1  溶液中先滴加5滴0.1 溶液中先滴加5滴0.1  溶液,再滴加5滴0.1 溶液,再滴加5滴0.1  溶液,观察是否出现沉淀 溶液,观察是否出现沉淀 |
| D | 探究 和 和 氧化性强弱 氧化性强弱 | 在 溶液中滴加酸化的过氧化氢溶液,观察溶液是否变为黄色 溶液中滴加酸化的过氧化氢溶液,观察溶液是否变为黄色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 下列离子方程式或电极反应式书写错误的是
A.向 溶液中滴加少量氨水,出现蓝色沉淀: 溶液中滴加少量氨水,出现蓝色沉淀: |
B.酸性条件下,电解丙烯腈( )生产己二腈[ )生产己二腈[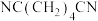 ]的阴极反应: ]的阴极反应: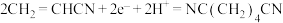 |
C.铅酸蓄电池放电时的正极反应: |
D.用纯碱溶液除去锅炉水垢中的 : : |
您最近一年使用:0次
解题方法
9 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
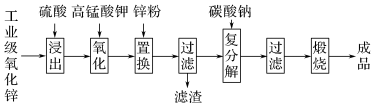
已知Ksp[Fe(OH)3]=8.0×10-38,回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写一种既可)
(2)浸出步骤中发生主要反应的离子方程式为
(3)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
□ +□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
+□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
(4)加入锌粉的目的是调节溶液pH除去Fe3+,和还原除去溶液中的
(5)已知H2SO4浸出液中,c(Fe2+)=50.4mg·L-1、c(Mn2+)=16.5mg·L-1,若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入
(6)若用酸性KMnO4标准溶液测定未知溶液中所含Fe2+的物质的量浓度(不含其他还原性粒子,MnO
 转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
您最近一年使用:0次
解题方法
10 . 一种硫酸镍粗品中含有 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。 ;
;
②部分金属离子(起始浓度为0.1 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1)“水浸”时常适当加热,加热的目的是___________ 。
(2)常温下,X是一种气体,则X、 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是___________ (用化学式表示),其原因是______________ 。
(3)“沉铁”时,总反应的离子方程式为______________ ;其中加入 的作用是调节溶液pH=
的作用是调节溶液pH=___________ (填字母)。
A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,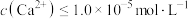 ,则最少加入
,则最少加入___________ g (保留三位有效数字)。
(保留三位有效数字)。
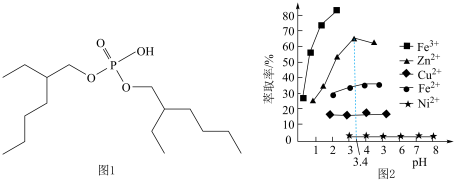
(5)萃取剂P204的结构简式如图1所示,1mol P204中含___________ mol手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为___________ 。
 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。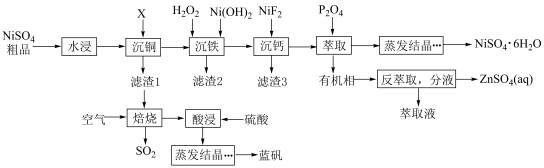
 ;
;②部分金属离子(起始浓度为0.1
 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:金属离子 |
|
|
|
|
|
|
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 8.2 | 8.3 | 8.9 | 13.8 |
(1)“水浸”时常适当加热,加热的目的是
(2)常温下,X是一种气体,则X、
 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是(3)“沉铁”时,总反应的离子方程式为
 的作用是调节溶液pH=
的作用是调节溶液pH=A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为
 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,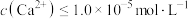 ,则最少加入
,则最少加入 (保留三位有效数字)。
(保留三位有效数字)。(5)萃取剂P204的结构简式如图1所示,1mol P204中含
您最近一年使用:0次




