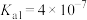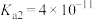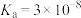2024高三下·全国·专题练习
1 . 已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=___________ ,并据此推断Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近一年使用:0次
2024高三下·全国·专题练习
2 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++ ,
,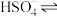 H++
H++ 。
。
①25℃时,Na2SO4溶液的pH___________ (填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数___________ (写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H2O+H2O H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为___________ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是___________ 。若保持温度不变,关于该所得溶液,下列说法正确的是___________ 。
A.加入少量冰醋酸,c( )与c(
)与c( )均减小
)均减小
B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c( )与c(
)与c( )的比值减小
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++
 ,
,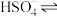 H++
H++ 。
。①25℃时,Na2SO4溶液的pH
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数
(2)液态水中,水存在自偶电离:H2O+H2O
 H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是
A.加入少量冰醋酸,c(
 )与c(
)与c( )均减小
)均减小B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(
 )与c(
)与c( )的比值减小
)的比值减小D.加入少量Na2SO4固体,c(Ac-)减小
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①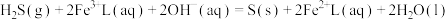

②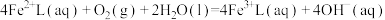
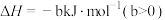
回答下列问题:
(1) 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
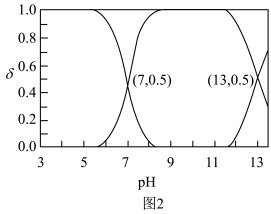
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,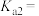
___________ 。再生反应在常温下进行,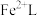 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的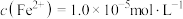 ,
,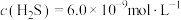 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为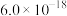 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
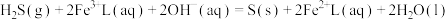

②
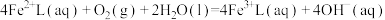
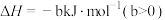
回答下列问题:
(1)
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
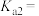
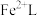 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的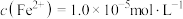 ,
,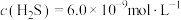 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为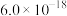 )。
)。
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 一定条件下,水气变换反应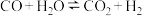 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
I.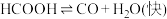
II.
研究发现,在反应I、II中, 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)反应I正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为___________  ,此时反应I的反应速率
,此时反应I的反应速率
___________  (用含
(用含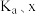 和k的代数式表示)。
和k的代数式表示)。
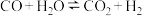 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:I.
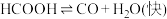
II.

研究发现,在反应I、II中,
 仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应I有催加速作用;反应I速率远大于反应II,近似认为反应I建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)反应I正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为 ,此时反应I的反应速率
,此时反应I的反应速率
 (用含
(用含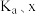 和k的代数式表示)。
和k的代数式表示)。
您最近一年使用:0次
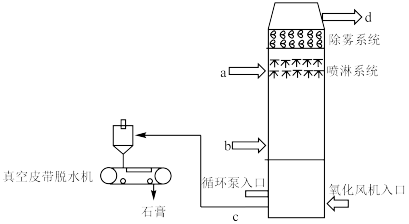
5 . 下图是石灰石膏法脱硫的示意图。烟气在脱硫塔内与脱硫剂(石灰石/生石灰浆液)接触混合,继而与鼓入的空气中的氧气发生化学反应,生成石膏(CaSO4·2H2O)。脱硫后的烟气经过除雾器除去雾滴后,排至大气。
1.烟气进口:_____ 。(填a或b)
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:_____ 。
| HCOOH | Ka=1.80×10-4 | |
| H2SO3 | Ka1=1.2×10-2 | Ka2=6.2×10-8 |
| H2CO3 | Ka1=4.2×10-7 | Ka2=4.8×10-11 |
1.烟气进口:
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:
您最近一年使用:0次
6 . 生物质铁炭纳米材料可以活化过一硫酸盐,降解废水中有机污染物.
(1)生物质铁炭纳米材料活化过—硫酸钾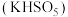 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中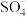 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基. (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: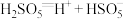 、
、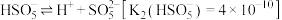 .写出
.写出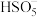 的结构式:
的结构式:_______ 。
②生物质铁炭纳米材料降解有机污染物的机理可描述为______ 。
③若有机污染物为苯酚,写出酸性条件下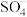 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:______ 。
(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:______ 。
(3)铁炭纳米材料在不同 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是:______ 。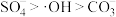 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是:______ 。
(1)生物质铁炭纳米材料活化过—硫酸钾
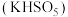 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中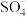 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基.
 (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: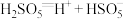 、
、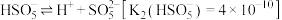 .写出
.写出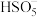 的结构式:
的结构式:②生物质铁炭纳米材料降解有机污染物的机理可描述为
③若有机污染物为苯酚,写出酸性条件下
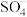 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:
(3)铁炭纳米材料在不同
 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是: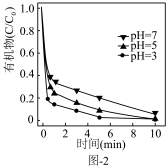
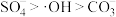 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是: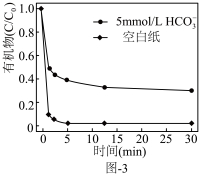
您最近一年使用:0次
名校
7 . 已知常温下部分弱电解质的电离平衡常数如下表所示:
(1)25℃时,pH=10的NaClO溶液中各离子浓度的大小关系为_______ (离子浓度如Na+的浓度以c(Na+)表示,下同)。向NaClO溶液中通入少量CO2,反应的离子方程式为_______ 。
(2)NH4Cl溶液中的电荷守恒关系式为_______ 。
(3)NH4F溶液显_______ (填酸性、碱性或中性)。
(4)物质的量浓度相同的NaNO2、NaClO两种溶液,pH较大的是_______ 。
(5)泡沫灭火器利用了硫酸铝溶液和碳酸氢钠溶液的反应,用离子方程式表示原理_______ 。
(6)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中 和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。_______ (填“A”或“B”)。
②当加入盐酸体积为50mL时,溶液中c( )∶c(NH3·H2O)=
)∶c(NH3·H2O)=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O | HNO2 |
| 电离常数 | 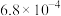 | 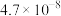 |  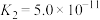 |  |  |
(1)25℃时,pH=10的NaClO溶液中各离子浓度的大小关系为
(2)NH4Cl溶液中的电荷守恒关系式为
(3)NH4F溶液显
(4)物质的量浓度相同的NaNO2、NaClO两种溶液,pH较大的是
(5)泡沫灭火器利用了硫酸铝溶液和碳酸氢钠溶液的反应,用离子方程式表示原理
(6)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中
 和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。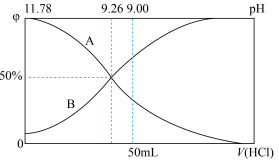
②当加入盐酸体积为50mL时,溶液中c(
 )∶c(NH3·H2O)=
)∶c(NH3·H2O)=
您最近一年使用:0次
8 . 回答下列问题
(1)现有a. b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_________ b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_________ b。
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_________ b。
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
①下列反应不能发生的是_________ (填序号)。
a.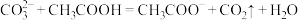
b.
c.
d.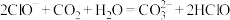
②反应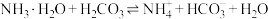 的平衡常数K=
的平衡常数K=_________ 。
(3)常温下,浓度均为0.1 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:
①上述盐溶液中的阴离子,结合 能力最强的是
能力最强的是 _________ 。
②根据表中数据,浓度均为0.01 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是_________ (填编号)。
A.HCN B.HClO C. D.
D.
(4)①已知t℃时,0.01 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中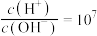 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
_________ 。
②25℃时,将体积 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为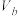 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
_________ 。
③25℃时,pH=5的醋酸和pH=5的 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为_________ 。
(1)现有a.
 b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
弱酸 |
|
|
| HClO |
电离平衡常数 |
|
|
|
|
a.
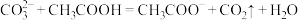
b.

c.

d.
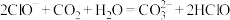
②反应
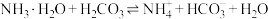 的平衡常数K=
的平衡常数K=(3)常温下,浓度均为0.1
 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:溶质 |
|
|
| NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 能力最强的是
能力最强的是 ②根据表中数据,浓度均为0.01
 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是A.HCN B.HClO C.
 D.
D.
(4)①已知t℃时,0.01
 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中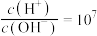 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
②25℃时,将体积
 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为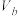 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
③25℃时,pH=5的醋酸和pH=5的
 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为
您最近一年使用:0次
名校
解题方法
9 . 已知如下四种物质① ②
② ③NaOH④
③NaOH④
1.写出①的电离方程式_____ 。
2.向②的溶液中滴加几滴浓盐酸,平衡_____ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
_____ (填“增大”、“减小”或者“不变”),
_____ (填“增大”、“减小”或者“不变”)。
3.将 的①溶液和
的①溶液和 的③溶液等体积混合后得到的溶液中主要溶质是
的③溶液等体积混合后得到的溶液中主要溶质是_____ (填化学式),该溶液显酸性,原因是_____ (请用文字结合该溶液中两个相关平衡方程式加以说明)。
4.将标准状况下2.24L④缓慢通入 的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为
的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为_____ ,该溶液中各离子浓度大小关系_____ 。
5.将足量④缓慢通入 的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度_____ 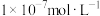 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH_____ (填“增大”、“减小”、或“不变”)。
 ②
② ③NaOH④
③NaOH④
1.写出①的电离方程式
2.向②的溶液中滴加几滴浓盐酸,平衡


3.将
 的①溶液和
的①溶液和 的③溶液等体积混合后得到的溶液中主要溶质是
的③溶液等体积混合后得到的溶液中主要溶质是4.将标准状况下2.24L④缓慢通入
 的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为
的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为5.将足量④缓慢通入
 的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度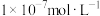 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近一年使用:0次
名校
10 . 25℃时部分弱酸的电离平衡常数如下表:
1.室温下① ②
② ③
③ ④
④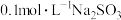 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)_____ 。
2.下列离子方程式书写正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  | 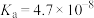 |   | 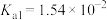  |
 ②
② ③
③ ④
④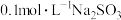 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)2.下列离子方程式书写正确的是
A.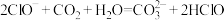 |
B. |
C. |
D. |
您最近一年使用:0次