名校
1 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(Ⅰ)的一种合成路线如下:
(1)化合物A的名称为___________ ,碳原子的杂化方式为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途___________ 。
(3)化合物C中含有的官能团名称为___________ ,请写出C转化为D的化学方程式___________ ,反应类型为___________ 。
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为___________ (写出一种)。
(5)参照上述路线,以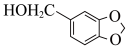 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图_______ 。
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途
(3)化合物C中含有的官能团名称为
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为
(5)参照上述路线,以
 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
您最近一年使用:0次
名校
解题方法
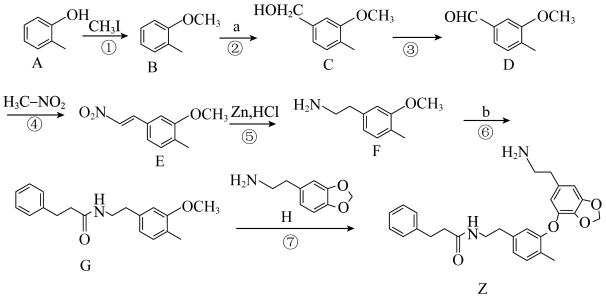
2 . 有机物K是重要的药物中间体,一种K的合成路线如下:
(1)A→B的反应条件是___________ 。D→E的反应类型为___________ 。
(2)F的结构简式为___________ 。
(3)I的化学名称是___________ 。J中官能团的名称是___________ 。
(4)反应B→C的化学方程式为___________ 。
(5)鉴别D的水溶液与I的水溶液的化学试剂为___________ 。
(6)L是D与乙醇酯化后的产物,同时满足下列条件的L的同分异构体有___________ 种;
①含有苯环;
②能发生水解反应且1molL需要2molNaOH发生反应。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为___________ (任写一种)。
已知:①
②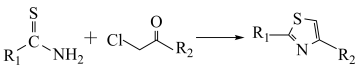
(1)A→B的反应条件是
(2)F的结构简式为
(3)I的化学名称是
(4)反应B→C的化学方程式为
(5)鉴别D的水溶液与I的水溶液的化学试剂为
(6)L是D与乙醇酯化后的产物,同时满足下列条件的L的同分异构体有
①含有苯环;
②能发生水解反应且1molL需要2molNaOH发生反应。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:1:1的物质的结构简式为
您最近一年使用:0次
3 . 氢燃料电池汽车是未来汽车发展的重要方向之一。二甲醚重整制氢技术是一种理想制氢方案。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为________________ 。
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=__________ kJ·mol-1。
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率_______ (填“变大”、“变小”或“不变”);根据以上反应判断,可采取_____________ (合理措施)来提高二甲醚的转化率(写一条)。
(3)在一个恒压 (起始体积为3 L)的密闭容器中充入2 mol CH3OH(g)和1 mol H2O(g),仅研究反应Ⅱ。CH3OH的平衡含量随温度、压强的变化如图所示。_______ P2(填“>”、“<”);B、C两点平衡常数KB_______ KC(填“>”、“<”或“=”);A点体积变为______ L,此时平衡常数KA的计算表达式为____________ (列式即可)。
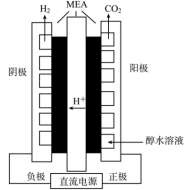
(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式______________ 。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率
(3)在一个

(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式
您最近一年使用:0次
名校
解题方法
4 . 苯甲酸可用于合成纤维、树脂涂料等,也可作为药物或防腐剂,有抑制真菌、细菌生长的作用。实验室利用高锰酸钾溶液氧化甲苯制备苯甲酸,其反应装置、制备原理如下:
②苯甲酸密度比水大,熔点122.13℃,沸点249.2℃,微溶于冷水,易溶于乙醇、热水,式量为122。
③高锰酸钾在中性溶液中被甲苯还原为二氧化锰。
(1)仪器 的名称为
的名称为______ ,冷凝水从______ 口流出(填“甲”或“乙”)。
(2)下列说法不正确 的是______。
(3)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作______ 。
(4)纯度测定:称取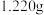 产品,配成
产品,配成 甲醇溶液,每次移取
甲醇溶液,每次移取 溶液。用
溶液。用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。产品中苯甲酸质量分数为
标准溶液。产品中苯甲酸质量分数为______ ,进一步纯化的方法是______ 。

②苯甲酸密度比水大,熔点122.13℃,沸点249.2℃,微溶于冷水,易溶于乙醇、热水,式量为122。
③高锰酸钾在中性溶液中被甲苯还原为二氧化锰。
(1)仪器
 的名称为
的名称为(2)下列说法
| A.将原料充分加热回流至回流液不再出现油珠,此时甲苯已完全被氧化 |
B.反应结束后,从分液漏斗中滴加适量 溶液,可除去过量的高锰酸钾 溶液,可除去过量的高锰酸钾 |
| C.将反应后的混合物充分冷却,先加入浓盐酸酸化,再过滤,可分离出苯甲酸 |
| D.提纯苯甲酸,可将粗苯甲酸加入热水溶解,趁热过滤,冷却结晶,再用乙醇洗涤 |
(3)提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作
(4)纯度测定:称取
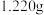 产品,配成
产品,配成 甲醇溶液,每次移取
甲醇溶液,每次移取 溶液。用
溶液。用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。产品中苯甲酸质量分数为
标准溶液。产品中苯甲酸质量分数为
您最近一年使用:0次
名校
5 . 金属元素 、
、 、
、 、
、 、
、 等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1) 是一种储氢材料。
是一种储氢材料。 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由小到大的顺序为___________ 。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,
表示,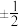 即称为电子的自旋磁量子数。对于基态
即称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为___________ 。
(3)① 是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则 的杂化轨道类型为
的杂化轨道类型为___________ (填标号)。
A. B.
B. C.
C. D.
D.
②如图为一种 形成的配离子的结构,加热时该离子先失去的配位体是
形成的配离子的结构,加热时该离子先失去的配位体是___________ (填化学式),此时生成的配离子溶液的颜色为___________ 色。 ,
,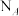 为阿伏加德罗常数的值。方程式
为阿伏加德罗常数的值。方程式 中X的化学式为
中X的化学式为___________ ,晶体中 周围距离最小且相等的
周围距离最小且相等的 有
有___________ 个,钛酸钡的密度为___________  。
。
 、
、 、
、 、
、 、
、 等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:(1)
 是一种储氢材料。
是一种储氢材料。 的空间构型是
的空间构型是(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,
表示,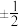 即称为电子的自旋磁量子数。对于基态
即称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为(3)①
 是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则 的杂化轨道类型为
的杂化轨道类型为A.
 B.
B. C.
C. D.
D.
②如图为一种
 形成的配离子的结构,加热时该离子先失去的配位体是
形成的配离子的结构,加热时该离子先失去的配位体是
 ,
,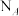 为阿伏加德罗常数的值。方程式
为阿伏加德罗常数的值。方程式 中X的化学式为
中X的化学式为 周围距离最小且相等的
周围距离最小且相等的 有
有 。
。
您最近一年使用:0次
名校
6 . 在实验室以二氧化锗粗品(含 和
和 及少量无关杂质)为原料制备
及少量无关杂质)为原料制备 的装置图如图(夹持装置已略去);
的装置图如图(夹持装置已略去); 和
和 均不溶于盐酸;
均不溶于盐酸; 易水解、易潮解,沸点为
易水解、易潮解,沸点为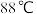 。
。
ii. (未配平);
(未配平); 。
。
回答下列问题:
(1)装置 中的离子反应方程式
中的离子反应方程式___________ 。
(2)仪器a的名称为___________ 。实验时,先将二氧化锗粗品转化为 ,为了防止烧瓶中盐酸浓度下降,实验过程中需要通过分液漏斗不断向装置A中滴加浓盐酸,盐酸需要保持较高浓度的原因为
,为了防止烧瓶中盐酸浓度下降,实验过程中需要通过分液漏斗不断向装置A中滴加浓盐酸,盐酸需要保持较高浓度的原因为___________ 。
(3)为更好地收集 ,装置
,装置 应采用
应采用___________ (填“热”或“冷”)水浴。
(4)将装置 中收集的
中收集的 与蒸馏水按一定比例进行混合,静置
与蒸馏水按一定比例进行混合,静置 ,可得到
,可得到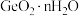 晶体,此过程中发生反应的化学方程式为
晶体,此过程中发生反应的化学方程式为___________ 。
(5)纯度测定:称取 制得的
制得的 样品,在加热条件下溶解,用
样品,在加热条件下溶解,用 将其还原为
将其还原为 ,用
,用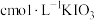 ,标准溶液滴定,消耗
,标准溶液滴定,消耗 标准溶液的体积为
标准溶液的体积为 ,需选用的滴定指示剂为
,需选用的滴定指示剂为___________ ,样品纯度为___________  。(实验条件下,
。(实验条件下, 未被
未被 氧化)
氧化)
 和
和 及少量无关杂质)为原料制备
及少量无关杂质)为原料制备 的装置图如图(夹持装置已略去);
的装置图如图(夹持装置已略去);
 和
和 均不溶于盐酸;
均不溶于盐酸; 易水解、易潮解,沸点为
易水解、易潮解,沸点为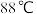 。
。ii.
 (未配平);
(未配平); 。
。回答下列问题:
(1)装置
 中的离子反应方程式
中的离子反应方程式(2)仪器a的名称为
 ,为了防止烧瓶中盐酸浓度下降,实验过程中需要通过分液漏斗不断向装置A中滴加浓盐酸,盐酸需要保持较高浓度的原因为
,为了防止烧瓶中盐酸浓度下降,实验过程中需要通过分液漏斗不断向装置A中滴加浓盐酸,盐酸需要保持较高浓度的原因为(3)为更好地收集
 ,装置
,装置 应采用
应采用(4)将装置
 中收集的
中收集的 与蒸馏水按一定比例进行混合,静置
与蒸馏水按一定比例进行混合,静置 ,可得到
,可得到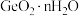 晶体,此过程中发生反应的化学方程式为
晶体,此过程中发生反应的化学方程式为(5)纯度测定:称取
 制得的
制得的 样品,在加热条件下溶解,用
样品,在加热条件下溶解,用 将其还原为
将其还原为 ,用
,用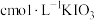 ,标准溶液滴定,消耗
,标准溶液滴定,消耗 标准溶液的体积为
标准溶液的体积为 ,需选用的滴定指示剂为
,需选用的滴定指示剂为 。(实验条件下,
。(实验条件下, 未被
未被 氧化)
氧化)
您最近一年使用:0次
7 . 某厂利用废旧铅蓄电池中的铅膏(主要成分为 、
、 、
、 和
和 ,还有少量铁、铝的氧化物)回收
,还有少量铁、铝的氧化物)回收 ,工艺流程如下:
,工艺流程如下: ,
, ,
, ,
, ,
, ,
, 。
。
(1)PbO中O元素的价电子的轨道表示式为___________ 。
(2)“脱硫”过程中涉及含 沉淀转化的离子方程式为
沉淀转化的离子方程式为___________ ,反应的平衡常数K的表达式___________ 。
(3)“酸浸”时, 能使
能使 转化为
转化为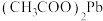 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 此外, 还能氧化溶液中的
还能氧化溶液中的___________ (填化学式或离子符号)。
(4)常温下,溶液中部分含铅物质的质量分数 与溶液
与溶液 变化的关系如图所示:
变化的关系如图所示: 由10增大到了11,发生反应的离子方程式为
由10增大到了11,发生反应的离子方程式为___________ 。
②“除杂”时,为了使 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图与已知的信息,需调节溶液
),结合图与已知的信息,需调节溶液 的理论范围为
的理论范围为___________ 。
(5)PbO的溶解度曲线如图所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在___________ (填“ ”或“
”或“ ”)浓度的
”)浓度的 溶液中,加热至
溶液中,加热至 ,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。
,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。
 、
、 、
、 和
和 ,还有少量铁、铝的氧化物)回收
,还有少量铁、铝的氧化物)回收 ,工艺流程如下:
,工艺流程如下: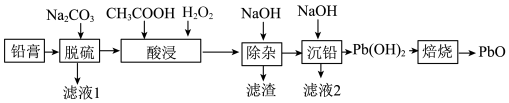
 ,
, ,
,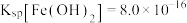 ,
, ,
, ,
, 。
。(1)PbO中O元素的价电子的轨道表示式为
(2)“脱硫”过程中涉及含
 沉淀转化的离子方程式为
沉淀转化的离子方程式为(3)“酸浸”时,
 能使
能使 转化为
转化为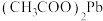 ,写出该反应的化学方程式
,写出该反应的化学方程式 还能氧化溶液中的
还能氧化溶液中的(4)常温下,溶液中部分含铅物质的质量分数
 与溶液
与溶液 变化的关系如图所示:
变化的关系如图所示:
 由10增大到了11,发生反应的离子方程式为
由10增大到了11,发生反应的离子方程式为②“除杂”时,为了使
 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图与已知的信息,需调节溶液
),结合图与已知的信息,需调节溶液 的理论范围为
的理论范围为(5)PbO的溶解度曲线如图所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在
 ”或“
”或“ ”)浓度的
”)浓度的 溶液中,加热至
溶液中,加热至 ,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。
,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。
您最近一年使用:0次
名校
解题方法
8 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备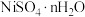 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。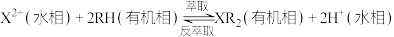 。
。
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有___________ (填元素符号)。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO___________ MgO(填“>”“<”或“=”),理由是___________ 。
(3)滤渣1的主要成分为___________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是___________ 。
(5)反萃取剂A为___________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为___________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备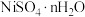 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。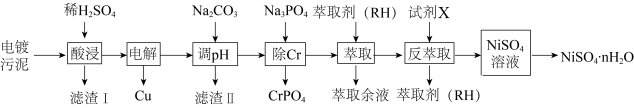
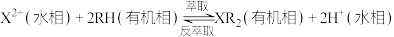 。
。回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:

②设
 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
9 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
名校
10 . 乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体。实验室中采用苯胺(在空气中易被氧化)和冰醋酸等原料制备乙酰苯胺,反应为: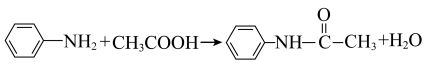 ;
;
| 摩尔质量(g/mol) | 熔点/℃ | 沸点/℃ | 密度/(g/cm³) | 溶解度/g | |||
| 水 | 乙醇 | 乙醚 | |||||
| 苯胺 | 93 | -6.2 | 184 | 1.022 | 3.6 | 混溶 | 混溶 |
| 冰醋酸 | 60 | 16.7 | 118 | 1.049 | 混溶 | 混溶 | 混溶 |
| 乙酰苯胺 | 135 | 115 | 305 | 1.212 | 溶于热水 | 溶 | 溶 |
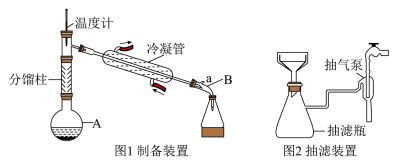
(1)加料:图1为制备装置(夹持、加热装置略),在仪器A中加入5.0mL苯胺、7.4mL冰醋酸和0.1g锌粉。仪器A的名称是
(2)加热制备粗产品;仪器A中加料后,加热至105℃。适宜使用
(3)过滤:反应结束后,将A中的反应混合物先趁热倒入适量冷水中,不断搅拌,使之充分冷却,再用图2所示的抽滤装置过滤。与普通过滤相比,抽滤的优点是
A.冷水 B.热水 C.乙醇 D.乙醚
(4)重结晶:①将粗乙酰苯胺放入适量水中,若观察到水中有油珠存在,可补加适量水,使油珠消失。根据下表乙酰苯胺的溶解度,上述水的温度选择
| 温度/℃ | 20 | 25 | 50 | 80 | 100 |
| 溶解度/g | 0.46 | 0.56 | 0.84 | 3.50 | 5.50 |
(5)产率计算:经过重结晶、干燥,得到乙酰苯胺产品5.0g,实验的产率是
您最近一年使用:0次



