名校
解题方法
1 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物 、
、 的结构已经确定,
的结构已经确定, 中存在O—O键。
中存在O—O键。
①依据数据推测O—O键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中O的化合价为
中O的化合价为___________ ,O的杂化形式为___________ 。
③ 中O的价层电子对数目为
中O的价层电子对数目为___________ ,VSEPR模型为___________ , 分子的空间结构为
分子的空间结构为___________ 。
(3)HF是一种有特殊性质的氢化物。向HF中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
 、
、 的结构已经确定,
的结构已经确定, 中存在O—O键。
中存在O—O键。 |  | |
| O-O键长/pm | 121 | 148 |

 (填“>”或“<”)。
(填“>”或“<”)。②
 中O的化合价为
中O的化合价为③
 中O的价层电子对数目为
中O的价层电子对数目为 分子的空间结构为
分子的空间结构为(3)HF是一种有特殊性质的氢化物。向HF中加入
 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:
您最近一年使用:0次
名校
2 . 他米巴罗汀是一种对白血病、阿尔茨海默症等疾病具有较好治疗效果的药物,其一种合成路线:
(1)A的结构简式是___________ ,C中含氧官能团的名称是___________ 。
(2)①和③的反应类型分别是___________ ,___________ 。
(3)草酰氯(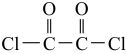 )与乙二胺(
)与乙二胺(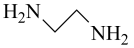 )反应可得到一种六元环状化合物,该反应的化学方程式为
)反应可得到一种六元环状化合物,该反应的化学方程式为___________ 。
(4)化合物W与C互为同分异构体,且满足下列条件:
①属于芳香族化合物且能与NaHCO3反应;
②能发生银镜反应;
③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应。
则W共有___________ 种,其中一种核磁共振氢谱为1:2:2:2:1,其结构简式为___________ 。
(5)参照上述合成路线,设计由苯和1,3-丁二烯合成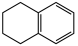 的路线(其它无机试剂任选)。
的路线(其它无机试剂任选)。___________
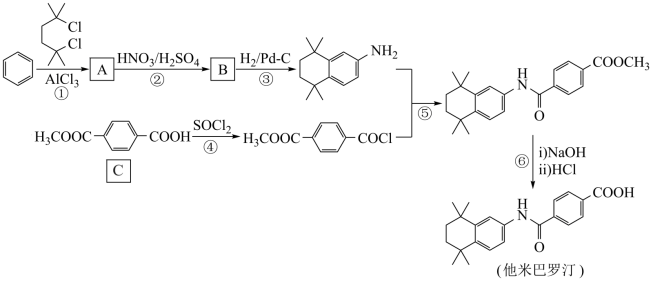
(1)A的结构简式是
(2)①和③的反应类型分别是
(3)草酰氯(
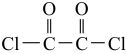 )与乙二胺(
)与乙二胺( )反应可得到一种六元环状化合物,该反应的化学方程式为
)反应可得到一种六元环状化合物,该反应的化学方程式为(4)化合物W与C互为同分异构体,且满足下列条件:
①属于芳香族化合物且能与NaHCO3反应;
②能发生银镜反应;
③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应。
则W共有
(5)参照上述合成路线,设计由苯和1,3-丁二烯合成
 的路线(其它无机试剂任选)。
的路线(其它无机试剂任选)。
您最近一年使用:0次
名校
3 . 锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。回答下列问题:
(1)锰元素在元素周期表中的位置是_______ ,基态锰原子的外围电子排布图为_______ 。
(2)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是_______(填标号)。
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有_______ ;锰试剂_______ (填“能”或“不能”)形成分子内氢键。_______ (填“sp”、“sp2”或“sp3”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为_______ (用元素符号表示)。
(5)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
(1)锰元素在元素周期表中的位置是
(2)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是_______(填标号)。
| A.F–F键的键能小于Cl–Cl键的键能 |
| B.三氟乙酸的Ka大于三氯乙酸的Ka |
| C.氟化氢分子的极性强于氯化氢分子的极性 |
| D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子 |
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有

(5)研究发现纳米CeO2可催化O
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。 
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为
您最近一年使用:0次
名校
解题方法
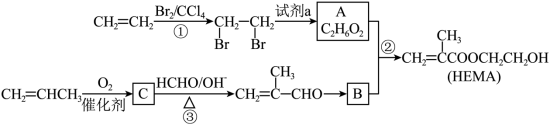
4 . 甲基丙烯酸羟乙酯(HEMA)是制隐形眼镜的材料,一种工业合成路线如下: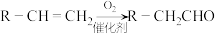
___________ ,试剂a是___________ 。
(2)②的反应类型是___________ ,A物质的名称为___________ 。
(3)B的结构简式是___________ 。
(4)①的化学方程式是___________ 。
(5)在B的同分异构体中,符合下列条件的结构简式为(不考虑立体异构):___________ 。
①能与 溶液反应
溶液反应
②不含环状结构
③核磁共振氢谱上有4组峰且峰的面积比为3∶1∶1∶1
(6)工业上以 为原料生产HEMA,还可利用反应:
为原料生产HEMA,还可利用反应: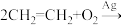
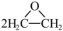 制备环氧乙烷,环氧乙烷可代替A,与B反应生成HEMA,与上述流程对比其优点是
制备环氧乙烷,环氧乙烷可代替A,与B反应生成HEMA,与上述流程对比其优点是___________ (答出一条即可)。
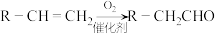
ii.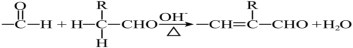
(2)②的反应类型是
(3)B的结构简式是
(4)①的化学方程式是
(5)在B的同分异构体中,符合下列条件的结构简式为(不考虑立体异构):
①能与
 溶液反应
溶液反应 ②不含环状结构
③核磁共振氢谱上有4组峰且峰的面积比为3∶1∶1∶1
(6)工业上以
 为原料生产HEMA,还可利用反应:
为原料生产HEMA,还可利用反应: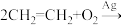
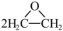 制备环氧乙烷,环氧乙烷可代替A,与B反应生成HEMA,与上述流程对比其优点是
制备环氧乙烷,环氧乙烷可代替A,与B反应生成HEMA,与上述流程对比其优点是
您最近一年使用:0次
名校
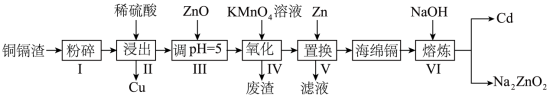
5 . 镉(Cd)可用于制作某些发光电子组件。一种用铜镉废渣(含Cd、Zn、Cu、Fe等单质)为原料制备镉的工艺流程如图。
回答下列问题:
(1)“步骤II”需隔绝氧气的原因是___________ 。
(2)“氧化”时KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式___________ ,废渣成分除了MnO2还有___________ 。
(3)“置换”时镉置换率与 的关系如图,其中Zn的理论用量以溶液中Cd2+量为依据。实际生产中
的关系如图,其中Zn的理论用量以溶液中Cd2+量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是___________ 。___________ 。(填化学式)
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH在反应釜中混合反应,反应的化学方程式是___________ ,当反应釜内无明显气泡产生时停止加热,利用Ca与Na2ZnO2的___________ 不同,将Cd从反应釜下口放出,以达到分离的目的。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)“步骤II”需隔绝氧气的原因是
(2)“氧化”时KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式
(3)“置换”时镉置换率与
 的关系如图,其中Zn的理论用量以溶液中Cd2+量为依据。实际生产中
的关系如图,其中Zn的理论用量以溶液中Cd2+量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是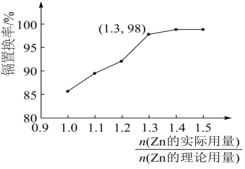
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH在反应釜中混合反应,反应的化学方程式是
您最近一年使用:0次
名校
6 . 双酚A主要用于生产聚碳酸酯、环氧树脂、聚砜树脂、聚苯醚树脂、不饱和聚酯树脂等高分子材料,其合成原理如图:
①将10.0g苯酚、17mL甲苯依次加入三口烧瓶中,烧瓶外用冷水冷却,在不断搅拌下加入7mL丙酮(过量),控制温度在15℃左右。
②当苯酚全部溶解,温度达到15℃时,保持匀速搅拌,并缓慢加入12mL 80%的硫酸,温度控制在18~20℃。
③缓慢加热至30~40℃,反应1h,当液体变得相当黏稠时,将反应后的溶液转移至50mL水中,静置冷却,搅拌、结晶,减压抽滤(用图2装置),用水洗涤滤渣至洗涤液呈中性后,再用滤纸进一步压干滤渣,然后进行烘干,得到双酚A粗产品。
请回答下列问题:
(1)仪器甲的名称为_______ ,仪器乙的作用为_______ 。
(2)步骤③中,反应温度控制在30~40℃,适合的加热方式为______ ,选择在此温度范围内反应的原因为_______ 。
(3)在该实验中,甲苯的作用为_______ ,加入过量丙酮的目的是_______ 。
(4)相比常压过滤,减压抽滤的优点为______ ,减压抽滤后得到的滤液中含有甲苯,提纯甲苯可_____ 法。
(5)利用甲苯将粗产品重结晶后,过滤、洗涤、干燥,最终得到5.4g双酚A,则双酚A的产率_______ (保留两位有效数字)。

①将10.0g苯酚、17mL甲苯依次加入三口烧瓶中,烧瓶外用冷水冷却,在不断搅拌下加入7mL丙酮(过量),控制温度在15℃左右。
②当苯酚全部溶解,温度达到15℃时,保持匀速搅拌,并缓慢加入12mL 80%的硫酸,温度控制在18~20℃。
③缓慢加热至30~40℃,反应1h,当液体变得相当黏稠时,将反应后的溶液转移至50mL水中,静置冷却,搅拌、结晶,减压抽滤(用图2装置),用水洗涤滤渣至洗涤液呈中性后,再用滤纸进一步压干滤渣,然后进行烘干,得到双酚A粗产品。

| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯酚 | 94 | 43.0 | 181.7 | 溶于水、乙醇,易溶于乙醚、甲苯 |
| 丙酮 | 58 | -95.4 | 56.0 | 与水、乙醇、乙醚、甲苯互溶 |
| 双酚A | 228 | 155.6 | 250.0 | 微溶于水、溶于丙酮、甲苯 |
| 甲苯 | 92 | -95.0 | 110.6 | 不溶于水,与乙醇、乙醚互溶 |
(1)仪器甲的名称为
(2)步骤③中,反应温度控制在30~40℃,适合的加热方式为
(3)在该实验中,甲苯的作用为
(4)相比常压过滤,减压抽滤的优点为
(5)利用甲苯将粗产品重结晶后,过滤、洗涤、干燥,最终得到5.4g双酚A,则双酚A的产率
您最近一年使用:0次
名校
7 . 扑热息痛是最常用的非抗炎解热镇痛药,对胃无刺激,副作用小。对扑热息痛分子进行结构表征,测得的相关数据和谱图如图。回答下列问题:
Ⅰ.确定分子式
(1)测定实验式:将15.1g样品在足量纯氧中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重8.1g和35.2g,再将等量的样品通入二氧化碳气流中,在氧化铜/铜的作用下氧化有机物中氮元素,测定生成氮气的体积为1.12L(已换算成标准状况)。该有机物是否含有氧元素_______ 。(填“是”或“否”)。
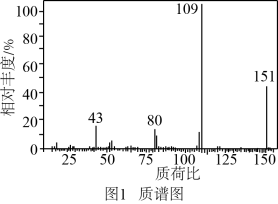
(2)确定分子式:测得目标化合物的质谱图如图1所示,其分子式为_______ 。
(3)用化学方法推断样品分子中的官能团。
①加入 溶液,无明显变化;
溶液,无明显变化;
②加入_______ (试剂)后显色,证明分子中含有酚羟基;
③水解反应后可以得到一种产物(可以在厨房找到其溶液)
(4)波谱分析
由图可知,该有机化合物分子含有_______ 种不同化学环境的H原子,其峰面积之比为_______ 。
(5)综上所述,扑热息痛的结构简式为_______ 。
(6)写出扑热息痛与NaOH反应的化学方程式_______ 。
Ⅰ.确定分子式
(1)测定实验式:将15.1g样品在足量纯氧中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重8.1g和35.2g,再将等量的样品通入二氧化碳气流中,在氧化铜/铜的作用下氧化有机物中氮元素,测定生成氮气的体积为1.12L(已换算成标准状况)。该有机物是否含有氧元素
(2)确定分子式:测得目标化合物的质谱图如图1所示,其分子式为
(3)用化学方法推断样品分子中的官能团。
①加入
 溶液,无明显变化;
溶液,无明显变化;②加入
③水解反应后可以得到一种产物(可以在厨房找到其溶液)
(4)波谱分析
①测得目标化合物的红外光谱图可知该有机物分子种存在: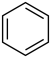 、—OH、
、—OH、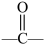 、
、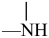 等基团
等基团

由图可知,该有机化合物分子含有
(5)综上所述,扑热息痛的结构简式为
(6)写出扑热息痛与NaOH反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。
(1)实验室以苯为原料制取苯胺,反应流程图如下:___________ 。
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液澜斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。___________ ;
②下列说法中正确的是___________ (填序号);
A.配混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中不断搅拌、冷却
B.浓硫酸可以降低该反应活化能
C.温度控制在50~60℃原因之一是减少副反应的发生
D.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤
(3)制取苯胺
b.先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
c.打开活塞K,通入 一段时间。
一段时间。
d.利用油浴加热。
e.反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
f.调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
①步骤b中温度计水银球的位置位于___________ (填字母,下同),步骤f中位于___________ 。
A.烧瓶内反应液中 B.贴近烧瓶内液面处 C.三颈烧瓶出气口(等高线)附近
②步骤d中利用油浴加热的目的是___________ ;步骤e中,加入生石灰的作用是___________ ;
③若实验中硝基苯用量为10mL,最后得到苯胺5.6g,苯胺的产率为___________ (写出计算过程,计算结果精确到0.1%)。
| 物质 | 相对分子质量 | 沸点℃ | 密度g/mL | 溶解性 |
| 硝基苯 | 123 | 210.9 | 1.23 | 不溶于水,易溶于乙醇、乙醚 |
| 苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚;还原性强、易被氧化 |
(1)实验室以苯为原料制取苯胺,反应流程图如下:

②1mol 生成1mol
生成1mol 过程中转移的电子数目为:
过程中转移的电子数目为:
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液澜斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。

②下列说法中正确的是
A.配混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中不断搅拌、冷却
B.浓硫酸可以降低该反应活化能
C.温度控制在50~60℃原因之一是减少副反应的发生
D.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤
(3)制取苯胺

b.先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
c.打开活塞K,通入
 一段时间。
一段时间。d.利用油浴加热。
e.反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
f.调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
①步骤b中温度计水银球的位置位于
A.烧瓶内反应液中 B.贴近烧瓶内液面处 C.三颈烧瓶出气口(等高线)附近
②步骤d中利用油浴加热的目的是
③若实验中硝基苯用量为10mL,最后得到苯胺5.6g,苯胺的产率为
您最近一年使用:0次
名校
解题方法
9 . 有机物A( )具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。部分相关物质的转化如下图:
)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。部分相关物质的转化如下图:
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
回答下列问题:
(1)A的结构简式为_______________ ,B可以发生的反应有__________ (填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称分别是_______________ 、_______________ 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:_______________ 、_______________ 。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是________________ 。
 )具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。部分相关物质的转化如下图:
)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。部分相关物质的转化如下图: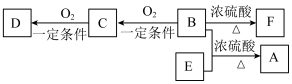
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
回答下列问题:
(1)A的结构简式为
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称分别是
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 钼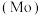 及其化合物广泛地应用于医疗卫生、国防等领域.某镍钼矿中的镍和钼以
及其化合物广泛地应用于医疗卫生、国防等领域.某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1) 位于元素周期表第
位于元素周期表第_______________ 周期第_______________ 族。
(2)“焙烧”中生成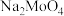 的化学方程式为
的化学方程式为_______________ 。
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图所示,分析实际生产中选择
浓度的影响如图所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______________ 。 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为_______________(填标号)。
,工艺流程中的“操作X”应为_______________(填标号)。
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______________ ”步骤。
(6)以钼酸铵为原料在一定条件下可以制备氮化钼,氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。_______________ ;氮化钼晶体的密度为_______________  ;将
;将 填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入
填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入_______________ 个 。
。
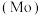 及其化合物广泛地应用于医疗卫生、国防等领域.某镍钼矿中的镍和钼以
及其化合物广泛地应用于医疗卫生、国防等领域.某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1)
 位于元素周期表第
位于元素周期表第(2)“焙烧”中生成
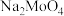 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图所示,分析实际生产中选择
浓度的影响如图所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为_______________(填标号)。
,工艺流程中的“操作X”应为_______________(填标号)。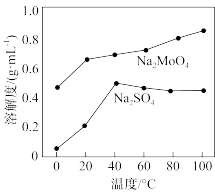
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)以钼酸铵为原料在一定条件下可以制备氮化钼,氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。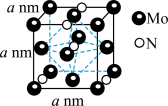
 ;将
;将 填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入
填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入 。
。
您最近一年使用:0次



