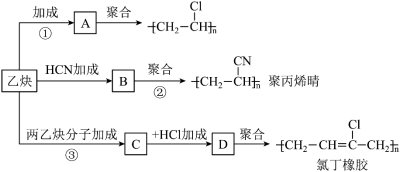
1 . 以乙炔为主要原料可合成聚乙烯、聚丙烯晴和氯丁橡胶,有关合成路线如图所示:___________ 。
(2)写出反应①方程式:___________ 。
(3)写出反应②方程式:___________ 。
(4)写出物质D的结构简式:___________ 。
(5)写出物质C的结构简式:___________ 。
已知反应:nCH2=CH-CH=CH2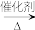
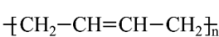
(2)写出反应①方程式:
(3)写出反应②方程式:
(4)写出物质D的结构简式:
(5)写出物质C的结构简式:
您最近一年使用:0次
名校
2 . 高纯MgO具有优良的电绝缘性、高导热性等,常被用作绝缘材料填料、高温耐热材料。由白云石[主要成分为 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下:
(1)请写出基态Ca原子的价电子排布式___________ 。
(2)步骤“煅烧1”中, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成 (
(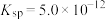 )。若铵浸液中
)。若铵浸液中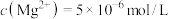 ,则其pH=
,则其pH=___________ ;滤饼“水化反应”后,将体系冷却到与铵浸液相同温度,得到主要含有 的悬浊液,其中
的悬浊液,其中
___________ 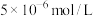 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(4)“沉钙”时主要发生反应的离子方程式为___________ 。
(5)“碳化反应”时,镁化合物转化为可溶于水的___________ (填化学式,下同),滤渣的主要成分为___________ 。
(6)“热解”时生成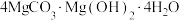 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下: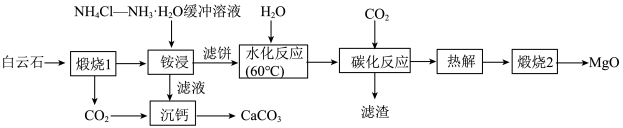
(1)请写出基态Ca原子的价电子排布式
(2)步骤“煅烧1”中,
 发生反应的化学方程式为
发生反应的化学方程式为(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成
 (
(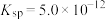 )。若铵浸液中
)。若铵浸液中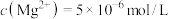 ,则其pH=
,则其pH= 的悬浊液,其中
的悬浊液,其中
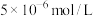 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(4)“沉钙”时主要发生反应的离子方程式为
(5)“碳化反应”时,镁化合物转化为可溶于水的
(6)“热解”时生成
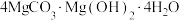 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
您最近一年使用:0次
名校
3 . 近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。回答下列问题:
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的_______ (填“高”或“低”),理由_______ 。
(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于_______ 晶体。
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
① 分子的空间构型为
分子的空间构型为_______ 。
② 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: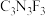 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式_______ 。
(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:_______ 。
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有_______ 。
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。_______ 。
②若GaAs晶体密度为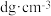 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为_______ cm(列出计算式即可)。
③稀磁性半导体材料中Mn、As的原子个数比为_______ 。
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。
①某同学画出基态Si原子的价层电子排布图: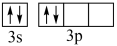 ,该电子排布图违背
,该电子排布图违背
 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用
 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。①
 分子的空间构型为
分子的空间构型为②
 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: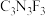 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:
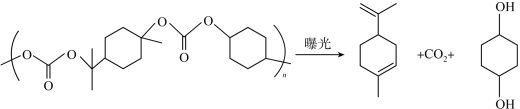
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。
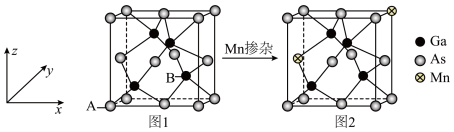
②若GaAs晶体密度为
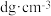 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为③稀磁性半导体材料中Mn、As的原子个数比为
您最近一年使用:0次
名校
解题方法
4 . CO2的捕获是实现资源利用的重要途径。
(1)烟气中CO2 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。_______ 。
(2)CO2和H2催化合成CH4。
主要发生反应为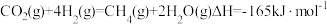 ,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。_______ 。
②高于320℃后,用Ni-CeO2作催化剂,CO2转化率略有下降,可能原因是_______ 。
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图2所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图3所示。_______ 。
②b电极生成HCOOH的电极反应式为_______ 。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是_______ 。
④控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
(1)烟气中CO2
 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。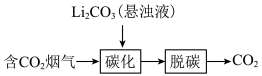
(2)CO2和H2催化合成CH4。
主要发生反应为
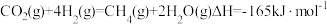 ,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
②高于320℃后,用Ni-CeO2作催化剂,CO2转化率略有下降,可能原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图2所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图3所示。
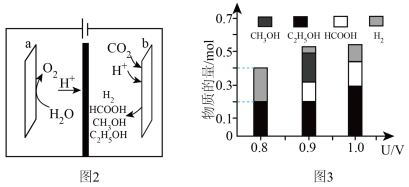
②b电极生成HCOOH的电极反应式为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
④控制电压为0.8V,电解时转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 利用含锌废料(主要成分是氧化锌,含有少量铁、铝、铜、锰等金属氧化物或盐)制备氯化锌的一种工艺流程如下:_______ 。(写出任意两点)
(2)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳pH范围为_______ ,理由是_______ 。
A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0
(3)滤渣的主要成分有Fe(OH)3、_______ 和MnO2,该工艺中去除锰的离子方程式为_______ 。
(4)最适宜使用的还原剂是_______ 。
(5)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐Zn(OH)Cl生成,该反应方程式为_______ 。
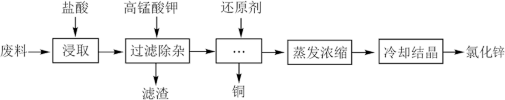
(2)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳pH范围为
A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0
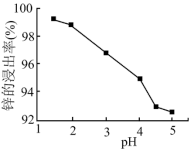
| 金属离子 | Fe2+ | Al3+ | Fe3+ | Cu2+ | Mn2+ | Zn2+ |
| 开始沉淀的pH c=0.01mol·L-1 | 6.8 | 3.7 | 1.8 | 5.2 | 8.6 | 6.7 |
| 沉淀完全的pH c=1.0×10-5mol·L-1 | 8.3 | 4.7 | 2.8 | 6.7 | 10.1 | 8.2 |
(4)最适宜使用的还原剂是
(5)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐Zn(OH)Cl生成,该反应方程式为
您最近一年使用:0次
名校
解题方法
6 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ ,原因是___________ 。
(2) 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为___________ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
(4)如图是硫的四种含氧酸根的结构: 转化为
转化为 的是
的是___________ (填标号)。理由是___________ 。
(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为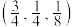 ,则B的原子坐标为
,则B的原子坐标为___________ 。
(1)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(2)
 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. |
C. | D. |
(4)如图是硫的四种含氧酸根的结构:
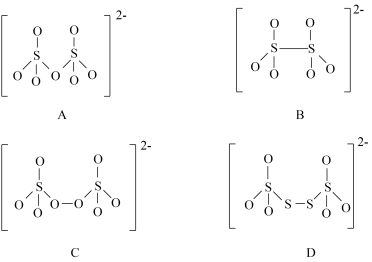
 转化为
转化为 的是
的是(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为
 ,则B的原子坐标为
,则B的原子坐标为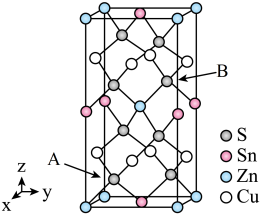
您最近一年使用:0次
名校
解题方法
7 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态As原子核外能量最高能级的电子云形状为___________ 。
(2)M与 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为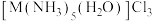 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是___________ (填字母)。
a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
② 含
含___________ molσ键。
③配合物T与 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成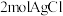 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为___________ 。
(3)常压、180℃时, 升华形成的二聚体
升华形成的二聚体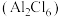 的结构如图所示。
的结构如图所示。___________ 。 的配位数为
的配位数为___________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的___________ (填“立方体”“正四面体”或“正八面体”)空隙中;若该晶体的密度为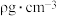 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________  (列式即可)。
(列式即可)。
(1)基态As原子核外能量最高能级的电子云形状为
(2)M与
 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为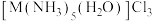 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
②
 含
含③配合物T与
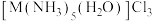 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。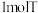 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成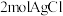 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为(3)常压、180℃时,
 升华形成的二聚体
升华形成的二聚体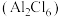 的结构如图所示。
的结构如图所示。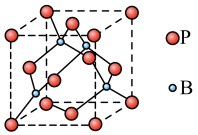
 的配位数为
的配位数为(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的
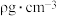 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为 (列式即可)。
(列式即可)。
您最近一年使用:0次
名校
解题方法
8 . 有机反应一般速率较小,副反应多,产物复杂。
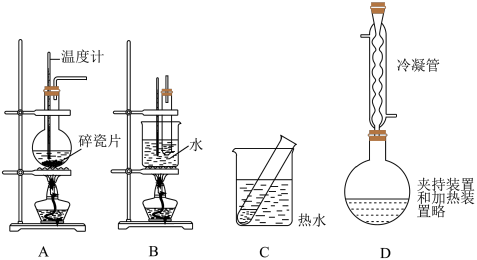
(1)常见的有机反应装置示意图,如下所示:_________ (填上图装置序号)。
②装置C可以做1-溴丙烷的水解反应实验,该反应的化学方程式为______________ 。
③实验室可用装置D制溴苯,下列有关说法不正确 的是_________ (填字母)。
a.圆底烧瓶中所装试剂为苯和浓溴水
b.冷凝管的作用是导气和冷凝回流,可以提高原料利用率
c.停止反应后,可直接通过分液将溴苯与苯分离
④写出上述①~③实验中消去反应的化学方程式:________________ 。
(2)检验反应的产物是判断有机反应类型的主要方法。下面是关于1-溴丙烷的实验及产物检验。
步骤I:向试管中加入少量1-溴丙烷,再加入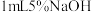 溶液,充分振荡,观察到溶液分为两层。
溶液,充分振荡,观察到溶液分为两层。
步骤Ⅱ:稍微加热一段时间后,冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴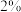 的
的 溶液。
溶液。
步骤Ⅲ:将下层液体取出,分离主要得到两种物质。经核磁共报氢谱验证,物质1分子中含有四种不同化学环境的H原子,其个数比为 ,物质2分子中含有三种不同化学环境的H原子,其个数比为
,物质2分子中含有三种不同化学环境的H原子,其个数比为 。
。
①步骤I中,1-溴丙烷主要存在于溶液的_________ 层(填“上”或“下”)。
②步骤Ⅱ中,试剂a为_________ ,加入 溶液后观察到的现象为
溶液后观察到的现象为__________________ 。
Ⅲ③写出步骤中物质2的结构简式:__________________ 。
④综合分析上述实验,实验中发生了取代反应,判断的理由是__________________ 。
(1)常见的有机反应装置示意图,如下所示:
②装置C可以做1-溴丙烷的水解反应实验,该反应的化学方程式为
③实验室可用装置D制溴苯,下列有关说法
a.圆底烧瓶中所装试剂为苯和浓溴水
b.冷凝管的作用是导气和冷凝回流,可以提高原料利用率
c.停止反应后,可直接通过分液将溴苯与苯分离
④写出上述①~③实验中消去反应的化学方程式:
(2)检验反应的产物是判断有机反应类型的主要方法。下面是关于1-溴丙烷的实验及产物检验。
步骤I:向试管中加入少量1-溴丙烷,再加入
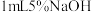 溶液,充分振荡,观察到溶液分为两层。
溶液,充分振荡,观察到溶液分为两层。步骤Ⅱ:稍微加热一段时间后,冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴
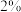 的
的 溶液。
溶液。步骤Ⅲ:将下层液体取出,分离主要得到两种物质。经核磁共报氢谱验证,物质1分子中含有四种不同化学环境的H原子,其个数比为
 ,物质2分子中含有三种不同化学环境的H原子,其个数比为
,物质2分子中含有三种不同化学环境的H原子,其个数比为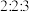 。
。①步骤I中,1-溴丙烷主要存在于溶液的
②步骤Ⅱ中,试剂a为
 溶液后观察到的现象为
溶液后观察到的现象为Ⅲ③写出步骤中物质2的结构简式:
④综合分析上述实验,实验中发生了取代反应,判断的理由是
您最近一年使用:0次
9 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中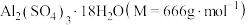 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
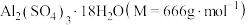 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
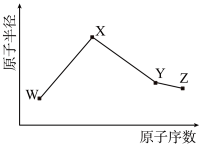
10 . W、X、Y、Z是元素周期表中的四种短周期元素,其相关信息及原子半径与原子序数的关系如表所示。请回答下列问题:
(1)W与X形成的含有共价键的常见化合物的电子式为_______ 。
(2)Y的价层电子排布式_______ 。
(3)Z的简单氢化物沸点比同主族上一周期元素简单氢化物沸点要_______ (填“高”或“低”)
(4)CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于顶点和面心,
位于顶点和面心, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。 距离最近的
距离最近的 数目为
数目为_______ 。
② CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为_______  。
。
| 元素 | 相关信息 | 原子半径与原子序数的关系 |
| W | 其一种核素的质量数为18,中子数为10 |
|
| X | 其原子与电子排布式为1s22s22p6的原子的核外电子数相差1 | |
| Y | 其单质是一种常见的半导体材料 | |
| Z | 电负性在同周期元素中最大 |
(1)W与X形成的含有共价键的常见化合物的电子式为
(2)Y的价层电子排布式
(3)Z的简单氢化物沸点比同主族上一周期元素简单氢化物沸点要
(4)CuS晶胞中
 的位置如图1所示,
的位置如图1所示, 位于顶点和面心,
位于顶点和面心, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
 距离最近的
距离最近的 数目为
数目为② CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。
您最近一年使用:0次