解题方法
1 . 对溴甲苯(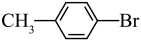 )是一种有机合成原料,广泛应用于医药合成。实验室以甲苯和溴为原料,制备对溴甲苯并证明其反应类型,装置如图所示。
)是一种有机合成原料,广泛应用于医药合成。实验室以甲苯和溴为原料,制备对溴甲苯并证明其反应类型,装置如图所示。
| 甲苯 | 溴 | 对溴甲苯 | |
| 沸点/℃ | 110 | 59 | 184 |
| 水溶性 | 难溶 | 微溶 | 难溶 |
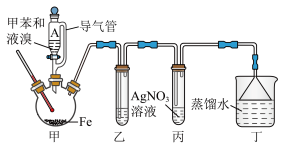
(1)装置甲中盛放铁粉的仪器名称为
(2)装置甲中生成对溴甲苯的化学方程式为
(3)甲苯和溴在光照下发生反应的化学方程式为
(4)装置乙中所盛放试剂的作用是
(5)取装置甲中反应后的混合物,经过下列操作可获得纯净的对溴甲苯:
步骤1:水洗,分液;
步骤2:用NaOH稀溶液洗涤,分液;
步骤3:水洗,分液;
步骤4:加入无水CaCl2粉末干燥,过滤;
步骤5:通过_______(实验操作),分离对溴甲苯和甲苯。
请根据上述实验回答下列问题:
步骤1→步骤3需要用到实验仪器——分液漏斗,分液时需要先
(6)关于该实验,下列说法正确的是_______(填字母)。
| A.溴有很强的挥发性,所以用溴水代替液溴制取产品的产率更高 |
| B.装置丙中的导管应插入溶液中,使气体反应充分 |
| C.装置丙中有淡黄色沉淀生成时,说明该反应为取代反应 |
| D.装置丁中放NaOH稀溶液,能吸收HBr防止污染环境,同时还能防倒吸 |
您最近一年使用:0次
2 . 将电能转化为化学能在生活生产和科学研究中具有重要意义。某学习小组用石墨电极持续电解 溶液。
溶液。
(1)t₁时刻,a极析出铜的电极反应式为___________ 。
(2)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知: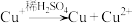 ,CuOH(黄色,不溶)
,CuOH(黄色,不溶)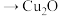 (红色,不溶)
(红色,不溶)___________ 。
②向试管ⅰ中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释沉淀由黄色变红色发生的化学反应方程式___________ 。
③证实从a极刮取的白色沉淀中含有CuCl的理由是___________ 。
(3)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生: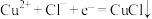 。
。
假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:___________ 。
(4) 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体。原因是
时a极产生气体。原因是___________ 。
(5)镀铜工业中,电镀液以 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,写出发生的离子反应方程式
(微溶)固体能有效解决该问题,写出发生的离子反应方程式___________ 。
 溶液。
溶液。| 实验 | 时刻 | 现象 |
|  | a极析出红色固体;b极产生气体用湿润的碘化钾淀粉试纸检验,试纸变蓝。 |
 | a极产生白色沉淀;a极附近溶液变为黄绿色;b极产生气体 | |
| … | … | |
 | a极产生气体;b极产生气体 |
(1)t₁时刻,a极析出铜的电极反应式为
(2)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知:
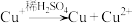 ,CuOH(黄色,不溶)
,CuOH(黄色,不溶)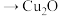 (红色,不溶)
(红色,不溶)
②向试管ⅰ中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释沉淀由黄色变红色发生的化学反应方程式
③证实从a极刮取的白色沉淀中含有CuCl的理由是
(3)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生:
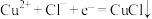 。
。假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:
(4)
 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体。原因是
时a极产生气体。原因是(5)镀铜工业中,电镀液以
 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,写出发生的离子反应方程式
(微溶)固体能有效解决该问题,写出发生的离子反应方程式
您最近一年使用:0次
3 . 铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的 溶液分解的对比实验时,放出
溶液分解的对比实验时,放出 的体积随时间的变化关系示意图(线a为使用
的体积随时间的变化关系示意图(线a为使用 作催化剂,线b为不使用催化剂),其中正确的图像是_______(填字母)。
作催化剂,线b为不使用催化剂),其中正确的图像是_______(填字母)。
(2)已知下列热化学为程式:
①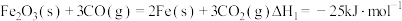
②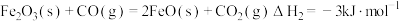
则Fe(s) + CO2(g) = FeO(s) + CO(g) ΔH=_______ kJ·mol-1。
(3)一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
_______ 
② 内,CO的平均反应速率
内,CO的平均反应速率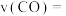
_______ 。
(4)下列描述能说明上述反应已达到平衡状态的是_______(填序号)。
(5)某化学兴趣小组利用反应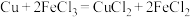 ,设计了如图所示的原电池装置。
,设计了如图所示的原电池装置。_______ 极(填”正”或“负”);b电极上的电极反应式为_______ 。
(1)以下是相同条件下,等体积等浓度的
 溶液分解的对比实验时,放出
溶液分解的对比实验时,放出 的体积随时间的变化关系示意图(线a为使用
的体积随时间的变化关系示意图(线a为使用 作催化剂,线b为不使用催化剂),其中正确的图像是_______(填字母)。
作催化剂,线b为不使用催化剂),其中正确的图像是_______(填字母)。A.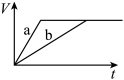 | B.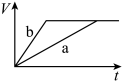 |
C.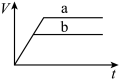 | D.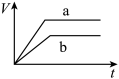 |
(2)已知下列热化学为程式:
①
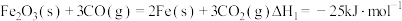
②
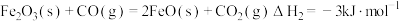
则Fe(s) + CO2(g) = FeO(s) + CO(g) ΔH=
(3)一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
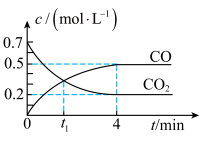
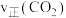
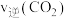
②
 内,CO的平均反应速率
内,CO的平均反应速率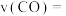
(4)下列描述能说明上述反应已达到平衡状态的是_______(填序号)。
A.  |
B.单位时间内生成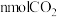 的同时,生成 的同时,生成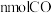 |
| C.容器中气体压强不随时间变化而变化 |
D.  和CO浓度相等 和CO浓度相等 |
(5)某化学兴趣小组利用反应
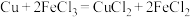 ,设计了如图所示的原电池装置。
,设计了如图所示的原电池装置。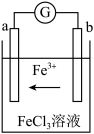
您最近一年使用:0次
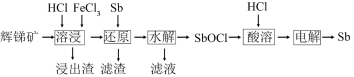
4 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下:
回答下列问题:
(1)Sb2S3中Sb的化合价为___________ 。
(2)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为___________ 。
(3)“还原”时加入Sb的目的是将___________ (填离子符号)还原,提高产物的纯度。
(4)“水解”时需控制溶液pH=2.5。
① Sb3+ 发生水解的离子方程式为___________ 。
②下列不能 促进该水解反应的措施是___________ (填字母)。
A.升高温度 B.增大c (H+)
C.增大c (Cl-) D.加入Na2CO3粉末
③根据表格数据分析:为避免水解产物中混入Fe(OH)3,c (Fe3+) 应小于___________ mol·L-1。
(5)“滤液”中含有的金属阳离子有Al3+、___________ 。
(6)Sb可由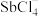 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为___________ 。
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c =0.01mol·L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c =1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)Sb2S3中Sb的化合价为
(2)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(3)“还原”时加入Sb的目的是将
(4)“水解”时需控制溶液pH=2.5。
① Sb3+ 发生水解的离子方程式为
②下列
A.升高温度 B.增大c (H+)
C.增大c (Cl-) D.加入Na2CO3粉末
③根据表格数据分析:为避免水解产物中混入Fe(OH)3,c (Fe3+) 应小于
(5)“滤液”中含有的金属阳离子有Al3+、
(6)Sb可由
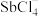 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应: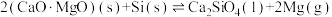
1.已知还原性:Mg>Si,上述反应仍能发生的原因是___________ 。
2.由下图,推测上述反应正向为___________ (填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时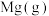 的浓度将
的浓度将___________ (填“升高”、“降低”或“不变”)。
4.若还原炉容积为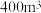 ,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率
,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率___________  。
。
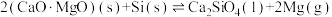
1.已知还原性:Mg>Si,上述反应仍能发生的原因是
2.由下图,推测上述反应正向为
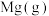 的浓度将
的浓度将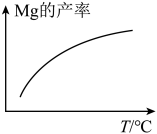
| A.反应物不再转化为生成物 |
B.炉内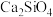 与CaO·MgO的质量比保持不变 与CaO·MgO的质量比保持不变 |
| C.气体密度变大 |
D.单位时间内,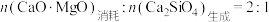 |
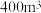 ,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率
,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率 。
。
您最近一年使用:0次
名校
解题方法
6 . 硫酸工业在国民经济中占有极其重要的地位。转化器中的催化氧化反应是硫酸生产的核心,其中转化率越高,原料利用率越高,对环境影响越小。
1.工业制硫酸生产中,下列条件或措施涉及化学平衡移动的是___________。
2.下表列出了不同温度、压强下 的平衡转化率:
的平衡转化率:
已知工业合成 选定的温度为450℃,选定的压强为常压,请简要说明选择常压而不是高压的原因:
选定的温度为450℃,选定的压强为常压,请简要说明选择常压而不是高压的原因:___________ 。
3.硫酸工业生产中 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为40℃,而工业生产中一般采用60℃的可能原因是
所用硫酸的适宜浓度为98.3%,适宜温度为40℃,而工业生产中一般采用60℃的可能原因是___________ 。
1.工业制硫酸生产中,下列条件或措施涉及化学平衡移动的是___________。
| A.矿石加入沸腾炉之前先粉碎 | B.净化后炉气中要有过量的空气 |
| C.转化器中不使用很高的温度 | D.吸收塔中用98.3%的浓硫酸吸收 |
 的平衡转化率:
的平衡转化率:| 温度/℃ |  的平衡转化率% 的平衡转化率% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
 选定的温度为450℃,选定的压强为常压,请简要说明选择常压而不是高压的原因:
选定的温度为450℃,选定的压强为常压,请简要说明选择常压而不是高压的原因:3.硫酸工业生产中
 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为40℃,而工业生产中一般采用60℃的可能原因是
所用硫酸的适宜浓度为98.3%,适宜温度为40℃,而工业生产中一般采用60℃的可能原因是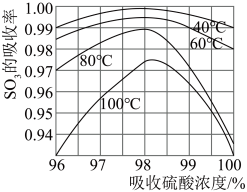
您最近一年使用:0次
7 . 回答下列问题。
(1)已知相关化学键的键能数据如下表:
则

___________  。
。
(2)利用污泥燃烧产生的还原性气体( 、CO等)可还原烟气中的
、CO等)可还原烟气中的 。CO还原NO的反应历程中相对能量变化如图1所示:
。CO还原NO的反应历程中相对能量变化如图1所示:
___________  ,该步骤的化学方程式是
,该步骤的化学方程式是___________ 。
(3)多晶Cu可高效催化 甲烷化,电解
甲烷化,电解 制备
制备 的原理示意图如图2所示。电解过程中温度控制在10℃左右,持续通入
的原理示意图如图2所示。电解过程中温度控制在10℃左右,持续通入 。阴、阳极室的
。阴、阳极室的 溶液的浓度基本保持不变。
溶液的浓度基本保持不变。___________ (填“阴”或“阳”)极,阳极上发生的电极反应式是___________ 。
②阴离子交换膜中传导的离子是___________ ,移动方向是___________ (填“从左向右”或“从右向左”)。
(1)已知相关化学键的键能数据如下表:
| 化学键 |  |  |  |  |  |
E/ | 436 | 414 | 464 | 326 | 803 |


 。
。(2)利用污泥燃烧产生的还原性气体(
 、CO等)可还原烟气中的
、CO等)可还原烟气中的 。CO还原NO的反应历程中相对能量变化如图1所示:
。CO还原NO的反应历程中相对能量变化如图1所示: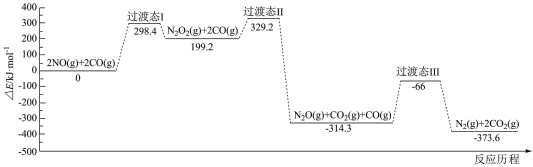
图1
该历程中最大能垒(活化能)
 ,该步骤的化学方程式是
,该步骤的化学方程式是(3)多晶Cu可高效催化
 甲烷化,电解
甲烷化,电解 制备
制备 的原理示意图如图2所示。电解过程中温度控制在10℃左右,持续通入
的原理示意图如图2所示。电解过程中温度控制在10℃左右,持续通入 。阴、阳极室的
。阴、阳极室的 溶液的浓度基本保持不变。
溶液的浓度基本保持不变。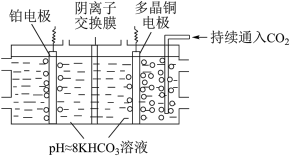
图2
①多晶Cu作②阴离子交换膜中传导的离子是
您最近一年使用:0次
8 . 近年来,化学界广泛开展研究二氧化碳与氢气的反应原理。回答下列问题:
(1)工业上可利用CO或 来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
①据反应 与
与 可推导出
可推导出 、
、 与
与 之间的关系,则
之间的关系,则
___________ (用 、
、 表示)。
表示)。
②500℃时测得反应 在某时刻
在某时刻 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.8、0.1、0.3、0.15,则此时
)分别为0.8、0.1、0.3、0.15,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(2)某装置中充入一定量 与
与 ,在673K、10.0kPa条件下发生反应:
,在673K、10.0kPa条件下发生反应: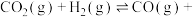
 ,得到部分气体的分压随时间的变化关系如图3所示:
,得到部分气体的分压随时间的变化关系如图3所示: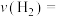
___________ kPa/min(保留两位有效数字)。
②已知反应在80min达到平衡状态,则在673K时,反应 的平衡常数
的平衡常数
___________ (保留两位有效数字)。
(3)在一装有某催化剂的恒容密闭装置中,充入10mol 和23mol
和23mol  ,在一定温度下发生反应:
,在一定温度下发生反应:
 .
. 和
和 .
. ,反应进行到
,反应进行到 时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如图4所示:
时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如图4所示: 时刻反应
时刻反应 的浓度熵
的浓度熵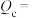
___________ (计算结果保留两位有效数字),b点时
___________ (填“是”或“否”)达到平衡状态。
② 时刻后,若升高装置温度,则重新达到平衡时,
时刻后,若升高装置温度,则重新达到平衡时,
___________ (填序号,下同),若将装置的体积缩小一倍,则重新达到平衡时,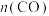
___________ 。
A.增大 B.减小 C.不变 D.无法确定
(1)工业上可利用CO或
 来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
 . .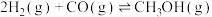 |  | 2.5 | 0.15 |
 . .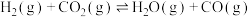 |  | 1.0 | 2.50 |
 . . |  | ||
 与
与 可推导出
可推导出 、
、 与
与 之间的关系,则
之间的关系,则
 、
、 表示)。
表示)。②500℃时测得反应
 在某时刻
在某时刻 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.8、0.1、0.3、0.15,则此时
)分别为0.8、0.1、0.3、0.15,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(2)某装置中充入一定量
 与
与 ,在673K、10.0kPa条件下发生反应:
,在673K、10.0kPa条件下发生反应: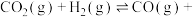
 ,得到部分气体的分压随时间的变化关系如图3所示:
,得到部分气体的分压随时间的变化关系如图3所示: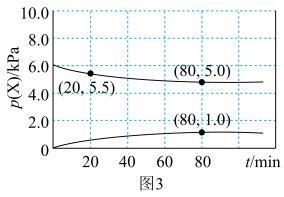
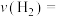
②已知反应在80min达到平衡状态,则在673K时,反应
 的平衡常数
的平衡常数
(3)在一装有某催化剂的恒容密闭装置中,充入10mol
 和23mol
和23mol  ,在一定温度下发生反应:
,在一定温度下发生反应: .
. 和
和 .
. ,反应进行到
,反应进行到 时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如图4所示:
时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如图4所示: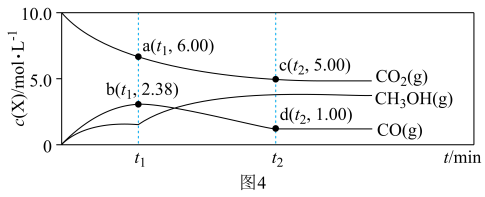
 时刻反应
时刻反应 的浓度熵
的浓度熵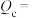

②
 时刻后,若升高装置温度,则重新达到平衡时,
时刻后,若升高装置温度,则重新达到平衡时,
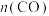
A.增大 B.减小 C.不变 D.无法确定
您最近一年使用:0次
名校
9 . 为探究乙炔与溴的加成反应,乙组同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。丙组同学发现在乙组同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能有少量含硫的还原性杂质气体(有臭鸡蛋气味)。由此他提出必须先除去杂质,再与溴水反应。
1.乙组同学设计的实验不能验证乙炔与溴发生加成反应,其理由是___________。
2.丙组同学为验证这一反应是加成而不是取代,提出可用pH试纸来测定反应前后溶液的酸性。理由是___________ 。
3.若分子式为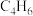 的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:
的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:___________ 。
4.由两种气态链烃(其中一种是烷烃)组成的混合气体20mL,在足量 中燃烧。恢复到室温后,混合气体体积减少了35mL,再将剩余气体通过碱石灰吸收,体积又减少40mL。则混合气体的组成为
中燃烧。恢复到室温后,混合气体体积减少了35mL,再将剩余气体通过碱石灰吸收,体积又减少40mL。则混合气体的组成为___________ 。
1.乙组同学设计的实验不能验证乙炔与溴发生加成反应,其理由是___________。
| A.使溴水褪色的物质,就是乙炔 | B.使溴水褪色的物质,未必是乙炔 |
| C.使溴水褪色的反应,就是加成反应 | D.使溴水褪色的反应,未必是加成反应 |
3.若分子式为
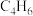 的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:
的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:4.由两种气态链烃(其中一种是烷烃)组成的混合气体20mL,在足量
 中燃烧。恢复到室温后,混合气体体积减少了35mL,再将剩余气体通过碱石灰吸收,体积又减少40mL。则混合气体的组成为
中燃烧。恢复到室温后,混合气体体积减少了35mL,再将剩余气体通过碱石灰吸收,体积又减少40mL。则混合气体的组成为
您最近一年使用:0次
名校
解题方法
10 . 乙炔是重要的化工原料,我校化学研究小组的同学进行了如下探究,甲组同学利用电石中的 与
与 反应制乙炔,并通过排水测量出反应产生的气体的体积,从而测定电石中
反应制乙炔,并通过排水测量出反应产生的气体的体积,从而测定电石中 的含量,实验装置如下。
的含量,实验装置如下。___________ 。写出制备乙炔的化学方程式___________ 。
2.研究性学习小组进行实验时,有下列操作(每项操作只进行一次)。
①仪器a中注入饱和食盐水,c中注入适量水。
②称取一定量电石,置于仪器b中,塞紧橡皮塞
③检查装置的气密性。
④待仪器b恢复到室温时,量取仪器d中水的体积(导管中水忽略不计)。
⑤慢慢开启仪器a的活塞,使饱和食盐水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是___________ 。(填写操作编号)
3.若实验时称取电石的质量为1.60g,测量出排水的体积后,折算成标准状况下 的体积为448mL,则此电石中
的体积为448mL,则此电石中 的质量分数为
的质量分数为___________ 。(假设其它物质不反应)
 与
与 反应制乙炔,并通过排水测量出反应产生的气体的体积,从而测定电石中
反应制乙炔,并通过排水测量出反应产生的气体的体积,从而测定电石中 的含量,实验装置如下。
的含量,实验装置如下。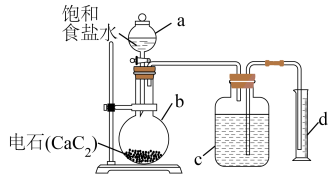
2.研究性学习小组进行实验时,有下列操作(每项操作只进行一次)。
①仪器a中注入饱和食盐水,c中注入适量水。
②称取一定量电石,置于仪器b中,塞紧橡皮塞
③检查装置的气密性。
④待仪器b恢复到室温时,量取仪器d中水的体积(导管中水忽略不计)。
⑤慢慢开启仪器a的活塞,使饱和食盐水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是
3.若实验时称取电石的质量为1.60g,测量出排水的体积后,折算成标准状况下
 的体积为448mL,则此电石中
的体积为448mL,则此电石中 的质量分数为
的质量分数为
您最近一年使用:0次




