名校
解题方法
1 . 化学是一门很需要细心的学科,做实验和做题时皆如此。有机物X的合成路线如图:___________ 。
(2)化合物B中官能团的名称___________ 。
(3)化合物D的分子式为___________ ,在一定条件下D能与 发生加成反应,请写出核磁共振氢谱为6组峰的产物的结构简式
发生加成反应,请写出核磁共振氢谱为6组峰的产物的结构简式___________ 。
(4)C的名称是___________ ,B与C反应生成D的化学方程式为___________ 。
(5)E的一氯代物有___________ 种。
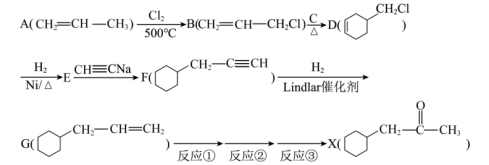
已知:
(2)化合物B中官能团的名称
(3)化合物D的分子式为
 发生加成反应,请写出核磁共振氢谱为6组峰的产物的结构简式
发生加成反应,请写出核磁共振氢谱为6组峰的产物的结构简式(4)C的名称是
(5)E的一氯代物有
您最近一年使用:0次
名校
2 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字)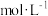 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000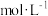 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000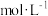 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
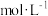 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000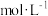 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次
名校
3 . 某化学兴趣小组设计图甲装置制备苯甲酸异丙酯,其反应原理如下:
实验步骤:
步骤ⅰ.在图甲干燥的仪器a中加入24.4g苯甲酸、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;
步骤ⅱ.加热至70℃左右保持恒温半小时;
步骤ⅲ.将图甲的仪器a中的液体混合物进行如下操作得到粗产品:
(1)图甲中仪器a的名称为_______ ,步骤ⅰ中选择的仪器a的容积大小为_______ (填标号)。
A.50mL B.100mL C.250mL D.500mL
(2)实验中,加入的异丙醇需过量,其目的是_______ 。
(3)本实验一般可采用的加热方式为_______ 。
(4)操作Ⅰ中饱和碳酸钠溶液洗涤的目的是_______ ,操作Ⅱ中加入无水硫酸镁的作用为_______ 。
(5)步骤ⅳ操作时应收集218℃的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为_______ (填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为27.88g,那么该实验的产率为_______ 。
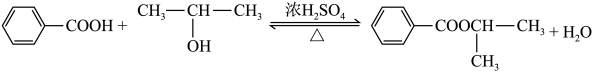

物质 | 相对分子质量 | 密度/( | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.08 | 218 | 不溶 |
步骤ⅰ.在图甲干燥的仪器a中加入24.4g苯甲酸、20mL异丙醇和10mL浓硫酸,再加入几粒沸石;
步骤ⅱ.加热至70℃左右保持恒温半小时;
步骤ⅲ.将图甲的仪器a中的液体混合物进行如下操作得到粗产品:


(1)图甲中仪器a的名称为
A.50mL B.100mL C.250mL D.500mL
(2)实验中,加入的异丙醇需过量,其目的是
(3)本实验一般可采用的加热方式为
(4)操作Ⅰ中饱和碳酸钠溶液洗涤的目的是
(5)步骤ⅳ操作时应收集218℃的馏分,如果温度计水银球位置偏上,则收集的精制产品中可能混有的杂质为
(6)如果得到的苯甲酸异丙酯的质量为27.88g,那么该实验的产率为
您最近一年使用:0次
名校
解题方法
4 . H、C、N、O、Na、Mg、Cl、Cu是8种中学化学中常见的元素。
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是___________ 。
② 3种元素Na、Mg、Cl中,原子半径最大的是___________ 。
③ 基态Cu的价电子排布式为___________ 。
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是___________ (填字母)。
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH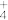 的原因是
的原因是___________ 。
③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是___________ 。
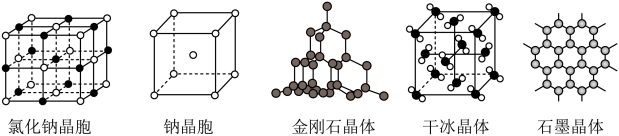
(3)不同聚集状态的物质与性质___________ 。
②金属钠能导电的原因是___________ 。
③NaCl、NaBr、NaI中,熔点最高的是___________ 。
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是___________ (填字母)。
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是
② 3种元素Na、Mg、Cl中,原子半径最大的是
③ 基态Cu的价电子排布式为
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH
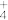 的原因是
的原因是③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是
(3)不同聚集状态的物质与性质
②金属钠能导电的原因是
③NaCl、NaBr、NaI中,熔点最高的是
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
您最近一年使用:0次
名校
5 . KCN易溶于水,水溶液呈碱性,虽有剧毒,却因其较强的配位能力被广泛使用,如用于从低品位的金矿砂(含单质金)中提取金。
(1)基态N价层电子排布式为_______ 。
(2) 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为_______ 。
(3) 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:_______ 。
(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含 的滤液;
的滤液;
ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于_______ 区元素。
②ⅰ中反应的离子方程式为_______ 。
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al_______ Si。
(7)硅的一种化合物 可发生水解反应,机理如下:
可发生水解反应,机理如下: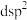 、②
、②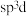 、③
、③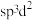 ,中间体
,中间体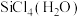 中Si采取的杂化类型为
中Si采取的杂化类型为_______ (填标号)。
(8)氯化铝常以二聚体的形式存在( )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头_______ 。
(1)基态N价层电子排布式为
(2)
 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为(3)
 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为 。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含
 的滤液;
的滤液;ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于
②ⅰ中反应的离子方程式为
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al
(7)硅的一种化合物
 可发生水解反应,机理如下:
可发生水解反应,机理如下:
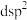 、②
、②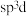 、③
、③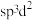 ,中间体
,中间体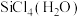 中Si采取的杂化类型为
中Si采取的杂化类型为(8)氯化铝常以二聚体的形式存在(
 )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
您最近一年使用:0次
6 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe、Mn等元素。回答下列问题:
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是_______ 。(填标号)
(2)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是_______ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是_______ 。_______ 。
②该锰的硅化物的化学式为_______ 。
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是
A. |
B. |
C. |
D. |
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是


②该锰的硅化物的化学式为
您最近一年使用:0次
名校
7 . 钴及其化合物广泛应用于航天、电池、磁性合金等高科技领域,我国钴资源贫乏,再生钴资源的回收利用是解决钴资源供给的重要途径.一种利用含钴废料(主要成分为 ,含少量
,含少量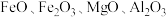 、有机物)制取
、有机物)制取 的工艺流程如下:
的工艺流程如下: ,回答下列问题:
,回答下列问题:
(1)“焙烧”的主要目的是____________ 。
(2)“浸取”过程中 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)“沉淀"时先加入 溶液,
溶液, 的作用主要是
的作用主要是_____________ 。再加入 溶液调节
溶液调节 为6.0,此时滤液中的
为6.0,此时滤液中的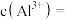
________  ,滤渣的主要成分为:
,滤渣的主要成分为:________ 。
(4)“萃取”用到的玻璃仪器主要有________ 烧杯。为得到纯净的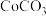 ,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?
,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?____________ 。
(5)萃取原理可表述为: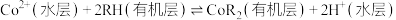 ,“反萃取”需加入A的水溶液,试剂A为
,“反萃取”需加入A的水溶液,试剂A为________ 。
 ,含少量
,含少量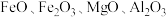 、有机物)制取
、有机物)制取 的工艺流程如下:
的工艺流程如下:
 ,回答下列问题:
,回答下列问题:金属离子 |
|
|
|
|
|
开始沉淀 | 7.5 | 1.8 | 3.4 | 9.1 | 6.5 |
沉淀完全 | 9.5 | 3.2 | 4.7 | 11.1 | 8.5 |
(1)“焙烧”的主要目的是
(2)“浸取”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)“沉淀"时先加入
 溶液,
溶液, 的作用主要是
的作用主要是 溶液调节
溶液调节 为6.0,此时滤液中的
为6.0,此时滤液中的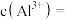
 ,滤渣的主要成分为:
,滤渣的主要成分为:(4)“萃取”用到的玻璃仪器主要有
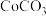 ,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?
,“沉钴”后要进行洗涤,如何判断沉淀是否洗涤干净?(5)萃取原理可表述为:
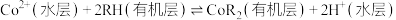 ,“反萃取”需加入A的水溶液,试剂A为
,“反萃取”需加入A的水溶液,试剂A为
您最近一年使用:0次
名校
8 . 金银花中抗菌杀毒的有效成分为绿原酸,绿原酸的一种合成路线如图所示。
(1)A中含有的官能团名称为_______ ;B的化学名称为_______ 。
(2)D→E的化学方程式为_______ ,E→F的反应类型为_______ 。
(3)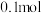 J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为_______ L。
(4)设计K→L的目的是_______ 。
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:_______ 。
A.能与 溶液发生显色反应
溶液发生显色反应
B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以 和
和 为原料合成
为原料合成 的路线
的路线_______ (无机试剂任选)。

已知: 。
。
(1)A中含有的官能团名称为
(2)D→E的化学方程式为
(3)
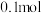 J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为(4)设计K→L的目的是
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:
A.能与
 溶液发生显色反应
溶液发生显色反应B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以
 和
和 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
7日内更新
|
45次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
名校
解题方法
9 . 乙酸苯酯是重要的药物中间体,它可以转化得到邻羟基苯乙酮和对羟基苯乙酮的混合物。一种制备乙酸苯酯的原理为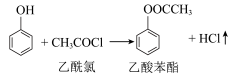 ,利用如图装置制备并提纯乙酸苯酯。
,利用如图装置制备并提纯乙酸苯酯。

已知所用试剂的部分物理性质如表所示:
| 物质 | 相对分子质量 | 部分物理性质 |
| 苯酚 | 94 | 常温下,纯净的苯酚是无色晶体,沸点为181.7℃,溶于水、乙醇,易溶于乙醚等有机溶剂 |
| 乙酰氯 | 78.5 | 常温下为无色发烟液体,沸点为52℃,溶于丙酮、乙醚等有机溶剂 |
| 乙酸苯酯 | 136 | 常温下为无色液体,沸点为195.5℃,微溶于水,可混溶于醇、氯仿、醚等有机溶剂 |
| 环己烷 | 84 | 常温下为无色有刺激性气味的液体,沸点为80.7℃,不溶于水,溶于乙醚、乙醇等有机溶剂 |
(1)仪器甲的名称为
(2)该原理制备乙酸苯酯的反应类型为
(3)其他条件相同,控制反应温度,不同温度下得到的乙酸苯酯的产率如表所示,选择表中
温度/℃ | 10 | 15 | 20 | 25 | 30 |
产率/% | 68.51 | 83.34 | 95.55 | 92.68 | 91.82 |
(4)实验结束后,进一步提纯乙酸苯酯的方法为
(5)在最佳温度下反应,最终得到乙酸苯酯的质量为
您最近一年使用:0次
7日内更新
|
21次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
10 . 铜、硫及其化合物在工业中用途广泛。请回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)硫酰氟 常温常压下为无色气体,固态
常温常压下为无色气体,固态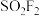 的晶体类型为
的晶体类型为___________ ,其F-S-F键角___________ (填“>”或“<”)硫酰氯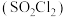 中的
中的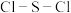 键角。
键角。
(3)硫酸四氨合铜晶体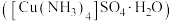 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备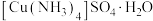 的流程如下:
的流程如下:
①写出过程 发生反应的离子方程式
发生反应的离子方程式___________ 。
②过程c加入 乙醇的作用是
乙醇的作用是___________ 。
③根据 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序___________ 。
(4)硫化铜的立方晶胞结构如图所示,已知 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长=___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)硫酰氟
 常温常压下为无色气体,固态
常温常压下为无色气体,固态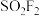 的晶体类型为
的晶体类型为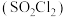 中的
中的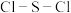 键角。
键角。(3)硫酸四氨合铜晶体
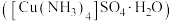 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备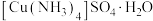 的流程如下:
的流程如下: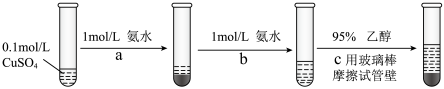
①写出过程
 发生反应的离子方程式
发生反应的离子方程式②过程c加入
 乙醇的作用是
乙醇的作用是③根据
 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序(4)硫化铜的立方晶胞结构如图所示,已知
 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长= (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次






 的
的 的
的

